Амониев нитрат
За информацията в тази статия или раздел не са посочени източници. Въпросната информация може да е непълна, неточна или изцяло невярна. Имайте предвид, че това може да стане причина за изтриването на цялата статия или раздел. |
| Амониев нитрат | |
|---|---|
| |
| Обща информация | |
| Систематично име | Амониев нитрат |
| Други имена | Амониева селитра |
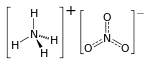
| Молекулна формула | NH4NO3 |
| SMILES | |
| Моларна маса | 80,04 g/mol |
| Външен вид | кристали |
| CAS номер | [6484-52-2] |
| Свойства | |
| Плътност и фаза | 1,725 g·cm−3 (20 °C), твърда |
| Разтворимост във вода | 150 g/100 ml (20 °C) 410 g/100 ml (60 °C) 1024 g/100 ml (100 °C) |
| В етанол | |
| Точка на топене | 169,6 °C |
| Точка на кипене | 210 °C (15 mbar). Разлага се над 170 °C при атмосферно налягане |
| Киселинност (pKa) | |
| Вискозитет | |
| Диполен момент | |
Опасности
 | |
| Основни опасности | Окислител, поддържа горенето, бризантен експлозив |
| Точка на възпламеняване | |
| Допълнителни данни | |
| Структура и свойства |
n, εr, и др. |
| Термодинамични данни |
Фазово поведение Твърдо състояние, течност, газ |
| Спектрални данни | УВ, ИЧ, ЯМР, МС |
| Сродни съединения | |
| Сродни съединения | амониев хлорид (нишадър) амониев сулфат амониев хидрооксид (амонячна вода) амониев карбонат (амонячна сода) |
| Освен където е обявено друго, данните са дадени за материали в стандартно състояние (при 25 °C, 100 kPa) Права и справки | |
Амониевият нитрат, наричан още амониева селитра е химическо съединение с емпирична формула NH4NO3. То е сол на амоняка с азотна киселина:
Много добре се разтваря във вода (около 117,4 g/100 g вода при 0 °C, 150,6 g/100g вода при 10 °C, 189,9 g/100 g вода при 20 °C и около 1 kg, 930,9 g/100 g вода при 100 °C). Процесът на разтваряне във вода е ендотермичен, затова температурата на сместа се понижава силно. По тази причина амониевият нитрат се използва понякога в охлаждащи смеси. Разтваря се и в течен амоняк. Кристалите на амониевия нитрат (получени при бавна кристализация във воден разтвор) са забележителни с това, че са много продълговати и се огъват. Съединението е богато на азот, който се съдържа както в аниона, така и в катиона. Това го прави предпочитан изкуствен азотен тор в селското стопанство, чист или в смес с други съединения. Амониевият нитрат е силно хигроскопичен, в зависимост от влажността на въздуха може да поеме влага и да се втечни или обратно, разтворът да се втвърди. Това води до честото му спичане на буци, затова се съхранява по възможност в плътно затворени съдове/опаковки. Високата разтворимост във вода, както и слабото задържане на амониевия нитрат от почвите води до измиването и изнасянето му в подпочвените води. Прекомерното торене води до екологични проблеми, както и до повишено съдържание на нитрати в земеделските култури. В България този изкуствен тор е много популярен. Тъй като дава бърз ефект при торене, с него често се злоупотребява вместо балансирано третиране заедна с калиеви и фосфорни минерални торове.
Амониевият нитрат, както и всички други амониеви соли, реагира с основи, при което се получава сол, вода и амоняк. По тази причина амониевите торове не трябва да се смесват с вар, тъй като това води до загуба на амонячния азот:
При нагряване (T > 170 °C) амониевият нитрат се разпада по уравнението:
при това се получават вода и райски газ. Амониевият нитрат е сравнително стабилно съединение при нормални условия. При силен първоначален импулс или при горене в големи количества в затворени пространства може да детонира:
При тази реакция амониевият катион действа като редуктор(=гориво) а нитратният анион като окислител, смесени на молекулярно ниво, с което се обяснява способността на амониевия нитрат да детонира. Продуктите на разпадането са изключително и само газообразни: азот, кислород и водна пара, което води до внезапно и силно повишаване на налягането (=експлозия).
Това му качество, от една страна, и фактът, че е кислородосъдържащо съединение, което лесно отдава кислорода си, (Кислороден баланс +0,2) го определят като съставна част на един клас експлозиви, по-малко чувствителни от динамита, но по действие близки до него. По-голямата част от промишлените ВВ са базирани на амониев нитрат. Особено интересни са появилите се ЕВВ (Емулсионни взривни вещества). През Втората световна война е бил широко използван за екслплозив и снаряди. Тези експлозиви съдържали от 50% до 80% амониев нитрат.
Амониевият нитрат се използва освен това и в пиротехнически смеси като окислител, макар и рядко, заради неговата хигроскопичност. В България са популярни „димки“, направени от напоени с амониев нитрат вестници, изсушени и свити на руло.
През месец май 1921 г. във фабрика на BASF в Опау (дн. Лудвигсхафен, Германия) избухнали около 4500 тона амониев нитрат. Както много пъти дотогава, работниците във фабриката използвали експлозиви, за да раздробят спечения амониев нитрат и процедурата се считала за безопасна. При инцидента са убити 509 души и ранени 1917. Кратерът, който се получил, бил с размери 165 m дължина, 96 m широчина и 18,5 m дълбочина. Тъй като на практика всички, участвали в инцидента, са загинали, точните причини за експлозията не са известни.
Заради експлозивните си свойства и свободния режим на продажба амониевият нитрат е често използван при терористични атаки. По тази причина в някои държави (например Германия) употребата на чист (несмесен с други вещества) амониев нитрат от физически лица е забранена със закон.
По-важни съединения на амониевия йон са амониев оксид (NH4)2O, амониев хидроксид NH4OH.



![{\displaystyle {\ce {NH4NO3->[{200 C°}]H2O + N2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b7036bb144a2aaffe595252e1969529ae4f63846)
