Ментол
| Ментол | |
 | |
| Имена | |
|---|---|
| По IUPAC | (2S)-(2-пропил)-(5R)-метил-(1R)-циклохексанол |
| Други | хексахидроментол |
| Свойства | |
| Формула | C10H20O |
| Моларна маса | 156,269 g·mol−1 |
| Външен вид | безцветен кристал |
| Плътност | 0,890 g·cm−3 |
| Точка на топене | 36 – 38 °C (рацемат) 42 – 45 °C изомер |
| Точка на кипене | 214,6 °C |
| Опасности | |
| Фрази за риск | R37/38, R41 |
| Фрази за безопасност | S26, S36 |
| NFPA 704 |
|
| Точка на запалване | 93 °C |
| Идентификатори | |
| CAS номер | 2216-51-5, 89-78-1 |
| PubChem | 16666 |
| ChemSpider | 15803 |
| DrugBank | DB00825 |
| KEGG | D00064 |
| ChEBI | 15409 |
| ChEMBL | 470670 |
| IUPHAR | 2430 |
| RTECS | OT0350000, рацемат |
| SMILES | CC1CCC(C(C1)O)C(C)C |
| InChI | 1S/C10H20O/c1-7(2)9-5-4-8(3)6-10(9)11/h7-11H,4-6H2,1-3H3/t8-,9+,10-/m1/s1 |
| InChI ключ | NOOLISFMXDJSKH-KXUCPTDWSA-N |
| UNII | BZ1R15MTK7 |
| Данните са при стандартно състояние на материалите (25 °C, 100 kPa), освен ако не е указано друго. | |
| Ментол в Общомедия | |
Ментолът е органично съединение, което се произвежда по изкуствен път или се набавя от маслата на ментата. Представлява кристално вещество без цвят, което е твърдо на стайна температура. Ментолът има локално упоително и успокоително свойство и се използва най-често за облекчаване на раздразнение на гърлото.
В Западния свят ментолът е изолиран за пръв път през 1771 г. от Йеронимус Давид Гаубий.[1]
Структура[редактиране | редактиране на кода]
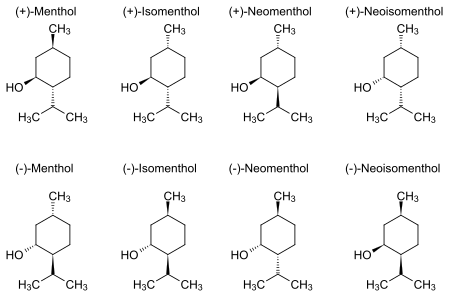
Ментолът в природата съществува под формата на чист стереоизомер, почти винаги като (1R,2S,5R). Осемте възможни стереоизомера са:
В естественото съединение изопропилната група е в транс ориентация спрямо метилната и хидроксилната групи. Следователно тя може да се изобрази по кой да е от следните начини:
Енантиомерите (+)- и (–)- на ментола са най-стабилните сред тези, базирани на своята циклохексанова конформация.
Двете кристални форми на рацематния ментол имат точка на топене съответно 28 °C и 38 °C. Чистият (−)-ментол има четири кристални форми, от които най-стабилна е α-формата.
Биологични свойства[редактиране | редактиране на кода]
Способността на ментола химически да задейства чувствителните към студ TRPM8 рецептори в кожата е отговорна за охлаждащото чувство, което човек изпитва при вдишване, поглъщане или допир на ментол.[2]
Аналгетичните свойства на ментола се постигат чрез избирателна активация на κ-опиоидните рецептори.[3] Освен това ментолът блокира натриевите канали, чувствителни към електрическо напрежение, като по този начин намалява невралната активност, която може да стимулира мускулите.[4]
Ментолът има широко приложение в стоматологията като локално антибактериално средство, ефективно срещу няколко вида стрептококи и лактобацили.[5]
В големи дози ментолът може да бъде смъртоносен за хората. Предозирането с него води до болки в корема, атаксия, предсърдно мъждене, брадикардия, кома, замаяност, летаргия, гадене, обриви, треперене, повръщане, световъртеж.[6]
Добиване[редактиране | редактиране на кода]
Естествен ментол се извлича чрез замразяване на масло от ментовия сорт Mentha × piperita. Получените ментолови кристали след това се отделят чрез филтрация.
Общото световно производство на ментол за 1998 г. е 12 хил. тона, от които 2,5 хил. тона са създадени по изкуствен път. Към 2005 г. годишното производство на синтетичен ментол е почти 5 хил. тона. Сред най-големите производители на ментол в света са Индия и Китай.[7]
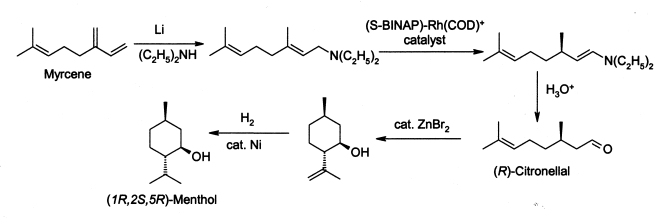
Около 3 хил. тона ментол годишно се произвеждат по метода на японеца Рьоджи Нойори (който е награден с Нобелова награда за химия през 2001 г. за това си откритие) за изомеризация на алилните амини:[8]
Процесът започва с образуването на алилен амин от мирцен, който се подлага на асиметрична изомеризация при наличието на BINAP родиев комплекс, при което се получава (след хидролиза) енантиомерически чист R-цитронелал. Той се циклизира чрез карбонилна енова реакция, започната от цинков бромид, до изопулегол, който на свой ред се хидрогенира, за да се получи чист (1R,2S,5R)-ментол.
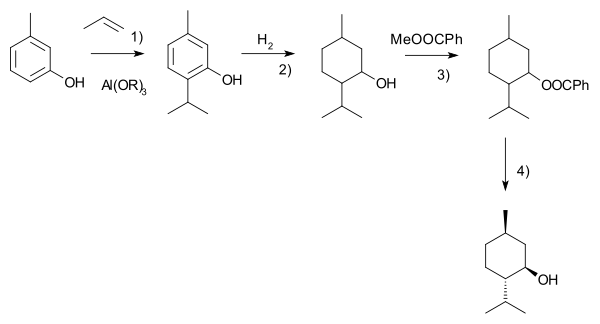
Друг процес е този на Харман-Раймер.[9] Той започва с m-крезол, който се алкализира с пропен до тимол. Това съединение се хидрогенира, а след това рацематният ментол се отделя чрез фракционна дестилация. Енантиомерите се отделят чрез хирална резолюция в реакция с метил бензоат, селективна кристализация и накрая хидролиза:
Източници[редактиране | редактиране на кода]
- ↑ Adversoriorum varii argumentii. Т. 1. Leiden, 1771. с. 99.
- ↑ Eccles, R. Menthol and Related Cooling Compounds // J. Pharm. Pharmacol. 46 (8). 1994. DOI:10.1111/j.2042-7158.1994.tb03871.x. с. 618 – 630.
- ↑ Galeotti, N. и др. Menthol: a natural analgesic compound // Neuroscience Letters 322 (3). 2002. DOI:10.1016/S0304-3940(01)02527-7. с. 145 – 148.
- ↑ Haeseler, G. и др. Voltage-dependent block of neuronal and skeletal muscle sodium channels by thymol and menthol // European Journal of Anaesthesiology 19 (8). 2002. DOI:10.1017/S0265021502000923. с. 571 – 579.
- ↑ Freires, I. A. и др. Antibacterial Activity of Essential Oils and Their Isolated Constituents against Cariogenic Bacteria: A Systematic Review // Molecules 20 (4). 2015-04-22. DOI:10.3390/molecules20047329. с. 7329 – 7358.
- ↑ Poisoning and Toxicology Handbook. 4th. Informa, 2008. ISBN 978-1-4200-4479-9. с. 885.
- ↑ Charles S. Sell. Terpenoids // Kirk-Othmer Chemical Technology of Cosmetics. 2013. ISBN 978-1-118-40692-2. с. 247 – 374.
- ↑ Japan: Takasago to Expand L-Menthol Production in Iwata Plant. FlexNews. 10/01/2008
- ↑ Schäfer, Bernd. Menthol // Chemie in Unserer Zeit 47 (3). 2013. DOI:10.1002/ciuz.201300599. с. 174 – 182.
|