Електролиза: Разлика между версии
Редакция без резюме |
Редакция без резюме |
||
| Ред 1: | Ред 1: | ||
[[Файл:Elektrolyse Allgemein.jpg|дясно|мини|300п|Схема на електролиза]] |
[[Файл:Elektrolyse Allgemein.jpg|дясно|мини|300п|Схема на електролиза]] |
||
'''Електролиза''' е физико-химичен процес, при който при преминаване на [[електрически ток]] през [[разтвор]] се получава отделяне върху [[електрод]]ите на съставните части на разтвореното вещество или на други вещества, получени при вторични реакции. Положителният електрод е [[анод]], а отрицателният [[катод]], положителните йони - [[катион]]и, а отрицателните - [[анион]]и. |
'''Електролиза''' е физико-химичен процес, при който при преминаване на [[електрически ток]] през [[разтвор]] се получава отделяне върху [[електрод]]ите на съставните части на разтвореното вещество или на други вещества, получени при вторични реакции. Положителният електрод е [[анод]], а отрицателният [[катод]], положителните йони - [[катион]]и, а отрицателните - [[анион]]и. |
||
При прилагане на [[напрежение]] на единия от [[електрод]]ите се установява излишък от [[електрон]]и (отрицателно зареден електрод, катод) а на другия недостиг на електрони (положително зареден електрод, анод). Отрицателно заредения електрод привлича положително заредените [[йон]]и (катиони) в разтвора, които се придвижват към него. Достигнали катода (-), йоните могат да приемат електрон(и) и да се [[редукция|редуцират]]: |
|||
: <math>\mathrm{2\ H^+ + 2 e^- \rightarrow \ H_2 \uparrow }</math> |
|||
По аналогия анионите се привличат от анода (+), там те отдават електрони и се [[окисление|окисляват]]: |
|||
: <math>\mathrm{4\ OH^- \rightarrow \ O_2 \uparrow + \ 2 H_2O + 4e^-}</math> |
|||
Горните процеси на редукция/окисление могат да се извършат само ако се превиши определена стойност на електродния потенциал. (За първата реакция |
|||
U <= 0 V, за втората U >= +1,23 V). |
|||
За да протекат двата процеса на електродите трябва да се приложи напрежение U = 1,23 - (0) = 1,23 V. |
|||
Понеже на електродите може да се приложи произволно напрежение на катода могат да се редуцират дори и най-силните редуктори а на анода да се окислят |
|||
дори и най-силните окислители. Затова се казва че '''катода е най-силния редуктор''' а '''анода най-силния окислител'''. Едва след откриването на електролизата станало възможно получаването на силни редуктори ( напр. [[натрий]], [[калий]]) и силни окислители (напр. [[хлор]], [[флуор]]). |
|||
За да се обменят един [[мол]] електрони e необходим електрически заряд от 96485 [[кулон]]а. Това се равнява числено на т.нар. константа на [[Фарадей]] '''F = 96485 C/mol'''. |
|||
Електролизата се използва широко в промишлеността. Тя е основният метод за получаване на [[водород]], [[натриева основа]], [[хлор]] и други. Прилага се също и за нанасяне на метални и неметални покрития върху метали. |
Електролизата се използва широко в промишлеността. Тя е основният метод за получаване на [[водород]], [[натриева основа]], [[хлор]] и други. Прилага се също и за нанасяне на метални и неметални покрития върху метали. |
||
{{commons|Electrolysis}} |
{{commons|Electrolysis}} |
||
{{химия-мъниче}} |
{{химия-мъниче}} |
||
Версия от 20:46, 31 август 2011
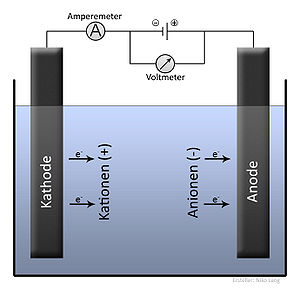
Електролиза е физико-химичен процес, при който при преминаване на електрически ток през разтвор се получава отделяне върху електродите на съставните части на разтвореното вещество или на други вещества, получени при вторични реакции. Положителният електрод е анод, а отрицателният катод, положителните йони - катиони, а отрицателните - аниони.
При прилагане на напрежение на единия от електродите се установява излишък от електрони (отрицателно зареден електрод, катод) а на другия недостиг на електрони (положително зареден електрод, анод). Отрицателно заредения електрод привлича положително заредените йони (катиони) в разтвора, които се придвижват към него. Достигнали катода (-), йоните могат да приемат електрон(и) и да се редуцират:
По аналогия анионите се привличат от анода (+), там те отдават електрони и се окисляват:
Горните процеси на редукция/окисление могат да се извършат само ако се превиши определена стойност на електродния потенциал. (За първата реакция U <= 0 V, за втората U >= +1,23 V). За да протекат двата процеса на електродите трябва да се приложи напрежение U = 1,23 - (0) = 1,23 V. Понеже на електродите може да се приложи произволно напрежение на катода могат да се редуцират дори и най-силните редуктори а на анода да се окислят дори и най-силните окислители. Затова се казва че катода е най-силния редуктор а анода най-силния окислител. Едва след откриването на електролизата станало възможно получаването на силни редуктори ( напр. натрий, калий) и силни окислители (напр. хлор, флуор).
За да се обменят един мол електрони e необходим електрически заряд от 96485 кулона. Това се равнява числено на т.нар. константа на Фарадей F = 96485 C/mol.
Електролизата се използва широко в промишлеността. Тя е основният метод за получаване на водород, натриева основа, хлор и други. Прилага се също и за нанасяне на метални и неметални покрития върху метали.



