Карбамид: Разлика между версии
м форматиране: 1x А|А(Б) |
Редакция без резюме |
||
| Ред 104: | Ред 104: | ||
|- |
|- |
||
|} |
|} |
||
'''Карбамид''' (също '''урея''' |
'''Карбамид''' (също '''урея''' или [[карбонил]]ди[[амид]]; да не се бърка с [[пикочна киселина]]) е [[органично съединение]], краен продукт на обмяната на веществата при много животни, получен при разграждането на азотните съединения (напр. аминокиселини). Отделя се отделя чрез [[урина]]та. Чистият карбамид е бяло кристално вещество със слаб мирис на амоняк. |
||
== История == |
== История == |
||
| Ред 116: | Ред 116: | ||
== Приложение == |
== Приложение == |
||
Поради високото си съдържание на азот 46%, |
Поради високото си съдържание на азот (46%), карбамидът е най-значимият азотен тор в световен мащаб. |
||
== Свойства == |
== Свойства == |
||
| Ред 122: | Ред 122: | ||
== Индустриален синтез == |
== Индустриален синтез == |
||
Карбамидът се произвежда индустриално в големи количества |
Карбамидът се произвежда индустриално в големи количества. Например през 2004 г. в света са произведени 127 млн. тона карбамид. |
||
Уравнения: |
Уравнения: |
||
| Ред 130: | Ред 130: | ||
:<math>\mathrm{\lbrack H_2N{-}CO{-}O \rbrack NH_4 \longrightarrow H_2N{-}CO{-}NH_2 + H_2O}</math> |
:<math>\mathrm{\lbrack H_2N{-}CO{-}O \rbrack NH_4 \longrightarrow H_2N{-}CO{-}NH_2 + H_2O}</math> |
||
:<small>амониевия карбамат се разпада до карбамид и вода.</small> |
:<small>амониевия карбамат се разпада до карбамид и вода.</small> |
||
Това е т. нар. |
Това е т. нар. процес на Бош—Майзер (Bosch—Meiser), разработен през 1922 г. Сумарният топлинен ефект е положителен. |
||
[[Категория:Уреи| ]] |
[[Категория:Уреи| ]] |
||
Версия от 21:11, 20 април 2017
Тази статия се нуждае от подобрение. Необходимо е: вкарване на шаблон за хим. съединение. Ако желаете да помогнете на Уикипедия, използвайте опцията редактиране в горното меню над статията, за да нанесете нужните корекции. |
| Карбамид | |
|---|---|
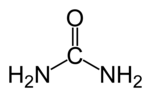
| |
| Обща информация | |
| Систематично име | Карбамид |
| Други имена | Карбонилдиамид
Диамид Урея Пиагран |
| Молекулна формула | CH4N2O |
| SMILES | |
| Моларна маса | 60,06 g/mol |
| Външен вид | кристали |
| CAS номер | [57-13-6] |
| Свойства | |
| Плътност и фаза | 1,3230 g.cm−3, твърда |
| Разтворимост във вода | 1000 g·l−1 (20 °C) |
| В етанол | 50 g·l−1 (20 °C) |
| Точка на топене | 132.5 – 134.5 °C |
| Точка на кипене | |
| Киселинност (pKa) | |
| Вискозитет | |
| Диполен момент | |
| Опасности | |
| Основни опасности | ? |
| Точка на възпламеняване | |
| Допълнителни данни | |
| Структура и свойства |
n, εr, и др. |
| Термодинамични данни |
Фазово поведение Твърдо състояние, течност, газ |
| Спектрални данни | УВ, ИЧ, ЯМР, МС |
| Сродни съединения | |
| Сродни съединения | |
| Освен където е обявено друго, данните са дадени за материали в стандартно състояние (при 25 °C, 100 kPa) Права и справки | |
Карбамид (също урея или карбонилдиамид; да не се бърка с пикочна киселина) е органично съединение, краен продукт на обмяната на веществата при много животни, получен при разграждането на азотните съединения (напр. аминокиселини). Отделя се отделя чрез урината. Чистият карбамид е бяло кристално вещество със слаб мирис на амоняк.
История
Карбамидът е първото синтетично получено органично съединение. Открит е през 1773 от Hilaire Rouelle. През 1828 е синтезиран за първи път от Фридрих Вьолер (на немски Friedrich Wöhler) при реакция на калиев цианат и амониев сулфат, което противоречало на тогавашното схващане, че органичните съединения могат да се синтезират само от живи същества чрез така наречената „жива сила“ „vis vitalis“. Това поставя началото на органичната химия.
Физиология
Карбамид се получава при белтъчната обмяна на веществата. За да се избегне отделянето на амоняк (NH3) при разграждането на белтъците, техните аминогрупи се свързват в черния дроб към безвредната молекула на карбамида.
Приложение
Поради високото си съдържание на азот (46%), карбамидът е най-значимият азотен тор в световен мащаб.
Свойства

Индустриален синтез
Карбамидът се произвежда индустриално в големи количества. Например през 2004 г. в света са произведени 127 млн. тона карбамид.
Уравнения:
- от амоняк и въглероден двуокис се получава амониев карбамат.
- амониевия карбамат се разпада до карбамид и вода.
Това е т. нар. процес на Бош—Майзер (Bosch—Meiser), разработен през 1922 г. Сумарният топлинен ефект е положителен.



