Дифузия
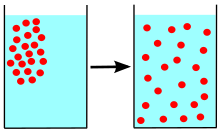
Дифузия е процес на пренос на субстанция или енергия (напр. атом, йон или молекула) от област с по-висока концентрация към област с по-ниска концентрация.[1] Дифузията може да бъде свободна (на незаредени частици) или несвободна, която от своя страна се дели на проста или облекчена (с помощ от преносител). Най-известния пример на дифузия е размесване на газове или течности. Друг пример свързан с твърдите тела: ако единият край на пръчка се нагрее, или се зареди електрически, се разпространява топлина (или съответно електрически ток) от горещата (заредена) част към студената (незаредена). Ако пръчката е метална, топлинната дифузия се развива по-бързо, а токът протича почти мигновено. Ако пръчката е от синтетичен материал, топлинната дифузия протича бавно, а дифузията на електрически заредените частици – много бавно. Дифузията на молекулите протича още по-бавно. Например, ако пуснем парче захар на дъното на чаша с вода и не разбъркваме водата, то ще минат няколко седмици преди разтвора да стане еднороден. Още по-бавно протича дифузията на едно твърдо вещество в друго. Например, ако мед се покрие със злато, то ще протича дифузия на злато в мед, но при нормални условия (стайна температура и атмосферно налягане) златният слой ще достигне дебелина няколко микрометра след няколко хиляди години.
Всички видове дифузия се подчиняват на едни и същи закони. Скоростта на дифузията е пропорционална на площта на напречното сечение на образеца, а също и на разликата в концентрациите, температурата или зарядите (в случай на относително неголеми стойности на тези параметри). Топлината ще се разпространява четири пъти по-бързо през пръчка с диаметър два сантиметра, отколкото през пръчка с диаметър един сантиметър. Тази топлина ще се разпространява два пъти по-бързо, ако разликата в температурата на един сантиметър бъде 10 °C вместо 5 °C. Скоростта на дифузията е пропорционална също и на параметър, характеризиращ конкретния материал. В случая на топлинна дифузия този параметър се нарича топлопроводност, за поток електрически заряди – електропроводност. Количеството вещество, което дифундира за определено време и разстояние е пропорционално на квадратен корен на времето.
Дифузията представлява процес на молекулярно ниво и се определя от случайния характер на движение на отделните молекули. Скоростта на дифузията е пропорционална на средната скорост на молекулите. В случая на газове, средната скорост на по-малките молекули е по-голяма, а именно тя е обратно пропорционална на квадратен корен на масата на молекулите и расте с повишаване на температурата. Дифузионните процеси в твърдите тела при високи температури често намират практическо приложение.
Ако в смес от газове една молекула е четири пъти по-тежка от друга, то такава молекула се придвижва два пъти по-бавно в сравнение ако се движи в чист газ. Съответно, скоростта на дифузията ѝ също е по-ниска. Тази разлика в скоростите на дифузия на леки и тежки молекули се използва, за да се разделят субстанции с различни молекулярни маси. Като пример може да се даде разделяне на изотопи. Ако газ, съдържащ два изотопа, се пропуска през пореста мембрана, по-леките изотопи проникват през мембраната по-бързо отколкото тежките.
От гледна точка на термодинамиката, движещ потенциал за всеки изравняващ процес е повишаването на ентропията. При постоянни налягане и температура в ролята на такъв потенциал играе химическия потенциал µ, обуславящ поддържането на потока вещество. Потока на частиците вещество е пропорционален при това на градиента на потенциала.
В повечето практични случаи вместо химичен потенциал се използва концентрацията C. Замяната на µ с C е некоректно в случай на малки концентрации, тъй като химичния потенциал е свързан с концентрацията по логаритмичен закон. Ако не разглеждаме такива случаи, то горната формула може да се замени със следната:
която показва, че плътността на поток вещество J [cm -2s-1] е пропорционален на коефициента на дифузия D [(cm2s - 1)] и градиента на концентрацията. Това уравнение е първият закон на Фик (Адолф Фик – немски физиолог). Втория закон на Фик свързва пространственото и времево изменение на концентрацията (уравнение на дифузията):
Коефициентът на дифузия D зависи от температурата. И нейната формула е: D=k.T.u, където T е абсолютна температура, а u е подвижност на частицата.
| Тази страница частично или изцяло представлява превод на страницата Diffusion в Уикипедия на английски. Оригиналният текст, както и този превод, са защитени от Лиценза „Криейтив Комънс – Признание – Споделяне на споделеното“, а за съдържание, създадено преди юни 2009 година – от Лиценза за свободна документация на ГНУ. Прегледайте историята на редакциите на оригиналната страница, както и на преводната страница, за да видите списъка на съавторите.
ВАЖНО: Този шаблон се отнася единствено до авторските права върху съдържанието на статията. Добавянето му не отменя изискването да се посочват конкретни източници на твърденията, които да бъдат благонадеждни. |



