Пеницилин
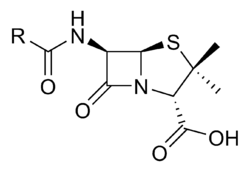
Пеницилинът е първият в света антибиотик, открит от Александър Флеминг през 1928 година. Пеницилинът спада към групата на бета-лактамите. Емпиричната му формула е R-C9H11N2O4S, където „R“ е остатък.
Антибиотиците от пеницилиновата група са производни на 6-аминопеницилановата киселина. Те потискат синтеза на бактериалната стена и действат бактерицидно само срещу размножаващи се микроорганизми.
Според спектъра си на действие се различават:
- тясноспектърни – биосинтетични и бета-лактамазоустойчиви
- широкоспектърни – аминопеницилини, карбоксипеницилини, уреидопеницилини
История
[редактиране | редактиране на кода]Откриването на пеницилина се приписва на шотландския учен Александър Флеминг през 1928 година. Разработката на пеницилина за употреба като лекарство се приписва на лауреатите на Нобелова награда за медицина Хауърд Флори и Ърнст Чейн.
Въпреки това, няколко други изследователи описват бактериостатичния ефект на Penicillium по-рано от Флеминг. Изглежда, че първата подобна публикация е направена през 1875 година от Джон Тиндал в Кралското дружество в Лондон.[1] Френският лекар Ернест Дюшен (Ernest Duchesne) документира смъртоносното въздействие на някои видове мухъл върху бактериите в публикация от 1894 г., която не е приета от института „Пастьор“ заради младостта му.
Флеминг разказва, че моментът на пробива му е в утрото на петък, 28 септември 1928 година.[2] Докато работи в лабораторията си в мазето на болницата Св. Мария в Лондон (сега част от Империъл Колидж), Флеминг забелязва „ореол“, в който липсва бактериален растеж около синьо-зеления мухъл, замърсяващ паничката на стафилококова бактериална култура. Той заключава, че мухълът освобождава субстанция, която потиска бактериалния растеж и разтваря клетките на бактерията. Отглежда чиста култура и открива, че това е пеницилиновия мухъл, сега познат като Penicillium notatum. Чарлз Том, американски специалист работещ в Министерството на земеделието на САЩ, е признат експерт и Флеминг отнася въпроса до него. Флеминг измисля термина „пеницилин“, за да опише филтрата на „бульонната“ култура на пеницилиновия мухъл. Дори в тези ранни етапи, пеницилинът се оказва най-ефективен срещу Грам-положителните бактерии, и неефективен срещу Грам-отрицателни организми и плесени. Първоначално Флеминг смята, че пеницилинът ще бъде полезен дезинфектант, тъй като е мощен при минимална токсичност в сравнение с антисептиците в онези дни и отбелязва неговата стойност при изолация на Bacillus influenzae (бактериална инфлуенца / грип, сега познат като Haemophilus influenzae).[3]. След по-нататъшни експерименти Флеминг е убеден, че пеницилинът не може да оживее достатъчно дълго в човешкото тяло, за да убие патогенните бактерии и спира да го изучава след 1931 г. През 1934 г. подновява клиничните проучвания до 1940 г.
Независимо от Флеминг в СССР пеницилинът е открит от съветската микробиоложка Зинаида Ермолева и използван за нуждите на съветската армия по време на Втората световна война.[4][5]
Употреба в медицината
[редактиране | редактиране на кода]С термина „пеницилин“ обикновено се използва за бензилпеницилин (пеницилин G), прокаин бензилпеницилин (прокаин пеницилин), бензатин бензилпеницилин (бензатин пеницилин) и феноксиметилпеницилин (пеницилин V).
Прокаин пеницилинът и бензатин пеницилинът имат същата антибактериална активност като бензилпенцилина, но действието им е по-дълготрайно. Феноксиметилпеницилинът е по-слабо активен към Грам отрицателни бактерии.[6][7] Бензилпеницилинът, прокаин пеницилинът и бензатин пеницилинът се прилагат парентерално (чрез инжекции), а феноксиметилпеницилинът – орално.
Странични ефекти
[редактиране | редактиране на кода]Честите странични ефекти (≥1% от пациентите) на пеницилина включват диария, хиперчувствителност, гадене, обрив, невротоксичност, уртикария и свръхинфекция (кандидоза). Рядко срещани странични ефекти (0,1 – 1% от пациентите) са треска, повръщане, еритема, дерматит, ангиоедем, припадък (особено при епилептици), както и псевдомембранозен колит.[8]
Механизъм на действие
[редактиране | редактиране на кода]
Бактериите непрекъснато обновяват своите пептидогликанови клетъчни стени, като едновременно изграждат и разрушават части от тях в процеса на растеж и делене. β-лактамните антибиотици потискат образуването на пептидогликанотите сшивки на клетъчната стена, но нямат директно отношение към разрушаването ѝ. β-лактамната функционална група на пеницилина се свързва за ензима (DD-транспептидаза), който съшива пептидогликановите молекули в клетъчната стена. От своя страна ензимът, който хидролизира клетъчната стена продължава да работи, като я отслабва – антибиотикът предизвиква цитолиза, тоест осмотична смърт). В допълнение, производството на пептидогликанови прекурсори причинява активирането на хидролази и автолиза, като се смила изграденият вече бактериален пептидогликан. Така полученият дисбаланс между съграждането и разграждането на клетъчната стена е отговорен за бързото бактерицидно действие на този клас антибиотици, дори и при липсата на клетъчно делене. В допълнение, относително малкият размер на пеницилиновата молекула му позволява да проникне дълбоко в клетъчната стена, като по този начин проявява ефекта си в цялата ѝ дълбочина.
Пеницилинът има синергичен ефект с аминогликозидите, като потискането на пептидогликановата синтеза позволява на аминогликозидите да проникнат през клетъчната стена и да достигнат до белтък-синтезиращия апарат много по-лесно.
Структура
[редактиране | редактиране на кода]

Скелетът на пеницилиновата молекула има следната формула R-C9H11N2O4S, където R е променлива странична верига.
Нормалният пеницилин (G) има моларна маса 313[9] до 334[10][11] g/mol. Различните пеницилини с прикачени различни функционални групи имат моларна маса около 500 g/mol. Например, клоксацилин 476 g/mol и диклоксацилин 492 g/mol.[12]
Биосинтеза
[редактиране | редактиране на кода]
Биосинтезата на пеницилин G се осъществява в три последователни етапа:
- Първата стъпка от биосинтезата на пеницилин G е кондензирането на три аминокиселини L-α-аминоадипова киселина, L-цистеин, L-валин в трипептид.[13][14][15] Преди кондензирането в трипептид обаче L-валина претърпява епимеризация до D-валин.[16][17] След кондензацията трипепридът се нарича δ-(L-α-аминоадипил)-L-цистеинил-D-валин, (ACV). Тази кондензация се осъществява от ензима δ-(L-α-аминоадипил)-L-цистеинил-D-валин синтетаза. Той е необходим и за епимеризацията на валина преди процеса на кондензация.
- При втората стъпка от биосинтезата на пеницилин G ензим конвертира ACV в изопеницилин N. Ензимът, осъществяващ тази реакция, се нарича изопеницилин N синтаза и се кодира от pcbC гена. В процеса на реакцията трипептидът ACV се окислява, което позволява пространственото приближаване и формиране на двучленен хетероцикъл.[13][14] Изопеницилин N има много слаба антибиотична активност.[16]
- При последната стъпка от биосинтезата на пеницилин G страничната група на изопеницилин N се заменя и се получава пеницилин G. Тази реакция се осъществява от ензима изопеницилин N ацилтрансфераза (IAT), който отстранява страничната алфа-аминоадипил групана изопеницилин N и я заменя с фенилацетилна група.[13]
Продукция
[редактиране | редактиране на кода]Пеницилинът е вторичен метаболит на плесените от род Penicillium, който се произвежда, когато растежът на плесента е спрян и тя е под стрес. Пеницилинът не се произвежда при активен растеж. Производството му също така се лимитира по пътя на обратната връзка.
- α-кетоглутарат + Ацетил-CoA → хомоцитратна киселина → L-α-аминоадипова киселина → L-лизин + β-лактам
Излишълът от L-лизин инхибира ппродукцията на хомоцитрат, така че наличието на екзогенен лизин при производство на пеницилин трябва да се избягва.
Клетките на Penicillium се култивират при така наречената фед-бач култура, при която клетките постоянно са подложени на стрес, необходим за синтеза на пеницилин. Изключително важен е и въглеродният източник: глюкозата потиска производството на пеницилин, а лактозата не. pH и нивата на азот, лизин, фосфати и кислород също са критични и трябва да се следят внимателно.
Източници
[редактиране | редактиране на кода]- ↑ Phil. Trans., 1876, 166, pp. 27 – 74]
- ↑ Kendall F. Haven, Marvels of Science (Libraries Unlimited, 1994) p. 182]
- ↑ Fleming A. On the antibacterial action of cultures of a penicillium, with special reference to their use in the isolation of B. influenzæ // Br J Exp Pathol 10 (31). 1929. с. 226 – 36.
- ↑ Литвиненко, Наталия. История первого антибиотика // Медицинский портал «МЕД-инфо». 10 януари 2012. (на руски)
- ↑ Зинаида Ермольева – “госпожа Пенициллин” // Фармацевт Практик. 17 ноември 2014. (на руски)
- ↑ Garrod, L. P. Relative Antibacterial Activity of Three Penicillins. // British Medical Journal (5172). 1960. с. 527 – 29.
- ↑ Garrod, L. P. The Relative Antibacterial Activity of Four Penicillins. // British Medical Journal (5214). 1960. с. 1695 – 6.
- ↑ Australian Medicines Handbook. Adelaide, Australian Medicines Handbook, 2006. ISBN 0-9757919-2-3.
- ↑ learnchem.net Stoichiometry Section: Percent Mass. By Takalah. Посетен на 9 януари 2009
- ↑ Drug Safety > Penicillin G Архив на оригинала от 2010-08-22 в Wayback Machine.. Посетен на 9 януари 2009
- ↑ SymplusWiki > penicillin G. Посетен на 9 януари 2009
- ↑ Barbosa S., Taboada P., Ruso J.M., Attwood D., Mosquera V. Complexes of penicillins and human serum albumin studied by static light scattering // Colloids and Surfaces A: Physicochemical and Engineering Aspects 224 (1 – 3). Август 2003. DOI:10.1016/S0927-7757(03)00322-4. с. 251 – 6.
- ↑ а б в Al-Abdallah, Q., Brakhage, A. A., Gehrke, A., Plattner, H., Sprote, P., Tuncher, A. Regulation of Penicillin Biosynthesis in Filamentous Fungi // Molecular Biotechnolgy of Fungal beta-Lactam Antibiotics and Related Peptide Synthetases. 2004. ISBN 3-540-22032-1. DOI:10.1007/b99257. с. 45 – 90.
- ↑ а б Brakhage, A. A. Molecular Regulation of b-Lactam Biosynthesis in Filamentous Fungi // Microbiol Mol Biol Rev. 62 (3). 1998. с. 547 – 85.
- ↑ Baldwin, J. E., Byford, M. F., Clifton, I., Hajdu, J., Hensgens, C., Roach, P, Schofield, C. J. Proteins of the Penicillin Biosynthesis Pathway // Curr Opin Struct Biol. (7). 1997. с. 857 – 64.
- ↑ а б Fernandez, F. J., Fierro, F., Gutierrez, S, Kosalkova, K. Marcos, A. T., Martin, J. F., Velasco, J. Expression of Genes and Processing of Enzymes for the Biosynthesis of Penicillins and Cephalosporms // Anton Van Lee 65 (3). September 1994. DOI:10.1007/BF00871951. с. 227 – 43.
- ↑ Baker, W. L., Lonergan, G. T. „Chemistry of Some Fluorescamine-Amine Derivatives with Relevance to the Biosynthesis of Benzylpenicillin by Fermentation“. J Chem Technol Biot. 2002, 77, pp1283-1288.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
