Закон на Бойл – Мариот
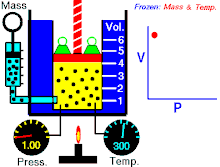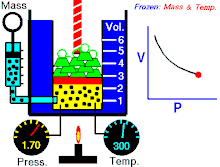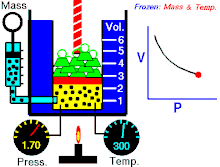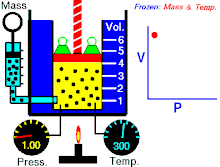
Законът на Бойл – Мариот (понякога просто наричан Закон на Бойл или Закон на Мариот във Франция) е закон за газовете и по-специално за идеалния газ. Законът описва как налягането на газ се увеличава при свиването му и обратното. Съвременната формулировка на закона на Бойл – Мариот гласи:
При постоянна температура обемът и налягането на идеален газ са обратнопропорционални.
Математическа формулировка:
| . | Налягането е обратнопропорционално на обема. |
Или:
| . | Произведението от обема и налягането е постоянна величина. |
В горните формули P е налягането, V е обемът на газа.
За едно и също вещество в две различни състояния законът може да бъде записан така:
Законът показва, че при изотермно увеличаване на обема на постоянно количество идеален газ налягането му намалява пропорционално. По същия начин с намаляването на обема се увеличава налягането на газа.
История
[редактиране | редактиране на кода]
Тази връзка между налягане и обем за първи път е забелязана от Ричърд Таунли и Хенри Пауър през седемнадесети век.[1] Робърт Бойл потвърждава тяхното откритие чрез експерименти и публикува резултатите си. Според Робърт Гюнтер и други учени, асистентът на Бойл, Робърт Хук, е този, който построява уредите за експериментите. Законът на Бойл се основава на експерименти с въздух, който той счита за поток от частици в покой между малките невидими извори. По това време въздухът все още е възприеман като един от четирите елемента, но Бойл не е съгласен. Интересът му вероятно е да разбере въздуха като съществен елемент от живота, така например той публикува статии за растежа на растенията без въздух.[2] Бойл използва затворена J-образна тръба и, след като излива живак от едната страна, той вкарва въздух от другата страна, за да се свие под натиска на живака. След като повтаря експеримента няколко пъти и използвайки различни колчества живак, той установява, че при контролирани условия, налягането на газа е обратнопропорционално на обема зает от него.[3]
Френският физик Едм Мариот (1620 – 1684) открива същия закон независимо от Бойл през 1679, но Бойл вече го е публикувал през 1662.[3] Мариот обаче открива, че обемът на въздуха се променя с температурата. По тази причина този закон понякога се нарича закон на Мариот или закон Бойл – Мариот.
По-късно през 1687 в „Математически начала на натурфилософията“ Исак Нютон показва математически, че при еластична течност, състояща се от частици в покой, между които действат отблъскващи сили, обратнопропорционални на тяхното разстояние, плътността е пряко пропорционална на налягането.[4] Този математически трактат обаче не е физическото обяснение за наблюдаваната връзка. Вместо статична теория е необходима кинетична теория, която е предоставена два века по-късно от Максуел и Болцман.
Този закон е първият физичен закон, който се изразява под формата на уравнение, описващо зависимостта на две променливи величини.
Дефиниция
[редактиране | редактиране на кода]Законът на Бойл е закон за газа, който гласи, че когато температурата се поддържа постоянна, налягането и обемът на газа имат обратно пропорционална връзка. Ако обемът се увеличава, налягането намалява и обратно. Следователно, когато обемът е намален наполовина, налягането се удвоява; и ако обемът се удвои, налягането се намалява наполовина.
Връзка с кинетичната теория и идеалните газове
[редактиране | редактиране на кода]Законът на Бойл посочва, че при постоянна температура обемът на дадена маса от сух газ е обратнопропорционален на неговото налягане.
Повечето газове се държат като идеални газове при умерено налягане и температура. Технологията от XVII век не е можела да предизвика високо налягане или ниски температури. Следователно е нямало вероятност законът да има отклонения по време на публикуването. Тъй като подобренията в технологиите позволяват по-високи налягания и по-ниски температури, отклоненията от поведението на идеалния газ стават забележими и връзката между налягане и обем може да бъде точно описана, използвайки теорията на реалния газ. Отклонението се изразява със степента на сгъстяване.
Бойл (и Мариот) извеждат закона единствено от експериментални основания. Законът също може да се извлече теоретично въз основа на предполагаемото съществуване на атоми и молекули и предположения за движение и перфектно еластични сблъсъци (вижте кинетична теория на газовете). Тези допускания са посрещнати с огромна съпротива в позитивистката научна общност по онова време, тъй като те са възприемани като чисто теоретични конструкти, за които няма и най-малък брой наблюдения.
Даниел Бернули извежда закона на Бойл през 1737 – 1738, използвайки законите на Нютон за движение с приложение на молекулярно ниво. Той остава пренебрегнат до около 1845, когато Джон Уотърстън публикува статия, в която се излагат основните правила на кинетичната теория; това е отхвърлено от Кралското дружество на Англия. По-късно работите на Джеймс Джаул, Рудолф Клаузиус и по-специално Лудвиг Болцман твърдо установяват кинетичната теория на газовете и насочват вниманието към двете теории на Бернули и Уотърстън.
Спорът между поддръжниците на енергетиката и атомизма карат Болцман да напише книга през 1898, която търпи критики до самоубийството му през 1906 година. През 1905 Алберт Айнщайн показа как кинетичната теория се прилага за Брауновото движение на частици, суспендирани в течност, което е потвърдено през 1908 от Жан Перин.
Уравнение
[редактиране | редактиране на кода]
Математичното уравнение на Закона на Бойл е:
където:
- P означава налягането на системата.
- V означава обемa на газа.
- k е константа, представяща температурата и обема на системата.
Докато температурата е постоянна, същото количество енергия, дадено на системата, се запазва и следователно теоретично стойността на k ще остане постоянна.
Дихателна система
[редактиране | редактиране на кода]Законът на Бойл често се използва като част от обяснението как действа дихателната система при животните. Това обикновено включва обяснение как обемът на белите дробове може да се увеличи или намали и по този начин да предизвика относително по-ниско или по-високо налягане на въздуха в тях (в съответствие със закона на Бойл). Това образува разлика в налягането между въздуха вътре в дробовете и налягането на въздуха в околната среда, което от своя страна причинява или вдишване, или издишване, когато въздухът се движи от зона с по-високо налягане към зона с по-ниско налягане.[5]
Вижте също
[редактиране | редактиране на кода]- Термодинамика
- Закон на Далтън – закон, описващ приноса на налягането на съставните газове в смес
- Закон на Шарл – връзката между обема и температурата на газа при постоянно налягане
Външни препратки
[редактиране | редактиране на кода]Източници
[редактиране | редактиране на кода]- ↑ Gerald James Holton (2001). Physics, the Human Adventure: From Copernicus to Einstein and Beyond. Rutgers University Press. pp. 270–. ISBN 978-0-8135-2908-0.
- ↑ The Boyle Papers BP 9, fol. 75v-76r at BBK.ac.uk Архив на оригинала от 2009-11-22 в Wayback Machine.
- ↑ а б Scientists and Inventors of the Renaissance. Britannica Educational Publishing. 2012. pp. 94 – 96.
- ↑ Principia, Sec.V,prop. XXI, Theorem XVI
- ↑ Gerald J. Tortora, Bryan Dickinson, 'Pulmonary Ventilation' in Principles of Anatomy and Physiology 11th edition, Hoboken: John Wiley & Sons, Inc., 2006, pp. 863 – 867




