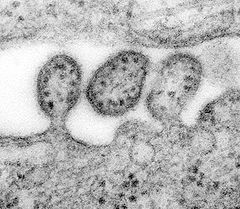
Ласа вирус
| Lassa mammarenavirus | ||||||||||||||
| Геном | ||||||||||||||
| Група V: евРНК вируси (ssRNA-) | ||||||||||||||
| Класификация | ||||||||||||||
| ||||||||||||||
| Научно наименование | ||||||||||||||
| [ редактиране ] |
Lassa mammarenavirus (LASV) е аренавирус, който причинява хеморагична треска при хора и други примати.[1][2] LASV е патоген, изискващ ниво на биобезопасност 4 за работа и съхранение. Той е ендемичен в страните от Западна Африка, особено в Сиера Леоне, Република Гвинея, Нигерия и Либерия, където годишната честота на инфекции с Ласа вирус е между 300 000 и 500 000 случая, със средно 5 000 – 10 000 смъртни случая годишно.[1]
От 2012 г. насам, открития в района на река Мано в Западна Африка разшириха ендемичната зона между двата известни ендемични района на Ласа, което показва, че LASV е по-широко разпространен в екозоната на тропическата гориста савана в Западна Африка.[3] Редица научни разработки целят създаването на ефективна ваксина, но момента няма официално одобрени ваксини срещу LASV за употреба при хора.[2][4][5]
Откриване
[редактиране | редактиране на кода]През 1969 г. медицинската сестра Лора Уайн се разболява от мистериозна болест, предадена ѝ от пациентка в Ласа, село в щата Борно, Нигерия.[6][7][8] След разболяването си, тя е транспортирана до Джос, където почива. Впоследствие още двама също се заразили, единият от които петдесет и две годишната медицинска сестра Лили Пинео, която се грижела за Лора Уайн.[9] Проби от Пинео са изпратени в университета Йейл в Ню Хейвън, където нов вирус, който по-късно ще бъде известен като Lassa mammarenavirus, е изолиран за първи път от Джорди Казалс-Ариет, Соня Бъкли и други.[10][11][12] В последствие, Казалс-Ариет се заразява и почти губи живота си, а един от лабораторните техници почива от заразата.[10] Около 1972 г. е установено, че африканският плъх от вида Mastomys natalensis е основният резервоар на вируса в Западна Африка, способен да отделя вирус в урината и изпражненията си, без да проявява видими симптоми.[13][14]
Вирусология
[редактиране | редактиране на кода]Структура и геном
[редактиране | редактиране на кода]
Lassa вирусите са обвити, едноверижни, бисегментирани, амбисенс РНК вируси.[16][17] Техният геном се съдържа в два РНК сегмента, които кодират два протеина всеки, по един във всяка посока на разчитане, допринасяйки общо четири вирусни протеина. Големият сегмент кодира малък протеин цинков пръст (Z), който регулира транскрипцията и репликацията и РНК полимеразата (L). Малкият сегмент кодира нуклеопротеина (NP) и повърхностния гликопротеинов прекурсор (GP, известен също като вирусен шип), който е протеолитично разцепен в гликопротеините на обвивката GP1 и GP2, които се свързват с алфа-дистрогликановия рецептор и спомагат за влизането в клетката гостоприемник.[18]
LASV причинява хеморагична треска, която често е съпътствана от симптоми на имунна недостатъчност (immunosuppression). Вирусът се репликира много бързо и демонстрира времеви контрол при репликацията. Първата стъпка на репликация е транскрипция на иРНК копия на генома с отрицателна посока на транскрипция. Това гарантира адекватно снабдяване с вирусни протеини за следващите етапи на репликация, тъй като NP и L протеините се транслират от иРНК. Положителният геном след това прави вирусни комплементарни РНК (vcRNA) копия на себе си. Копията на РНК са шаблон за производство на нови вирусни частици с отрицателна посока на транскрипция, но иРНК също се синтезира от него. мРНК, синтезирана от vcRNA, се транслира, за да направи GP и Z протеините. Този времеви контрол позволява на шиповите протеини да се произвеждат последни и следователно да забавят разпознаването на вируса от имунната система на гостоприемника.
Нуклеотидните изследвания на генома показват, че Lassa има четири щама: три открити в Нигерия и четвърти в Гвинея, Либерия и Сиера Леоне. Нигерийските щамове вероятно са били предци на другите, но е необходима допълнителна работа, за да се потвърди това.[19]
Рецептори
[редактиране | редактиране на кода]
Lassa mammarenavirus навлиза в клетката гостоприемник посредством рецептора на клетъчната повърхност алфа-дистрогликан (алфа-DG),[20] универсален рецептор за протеини на извънклетъчния матрикс. Той споделя този рецептор с прототипния вирус на аренавирус от Стария свят на лимфоцитен хориоменингит (Lymphocytic_choriomeningitis, LCMV). Рецепторното разпознаване зависи от специфична захарна модификация на алфа-дистрогликан от група гликозилтрансферази, известни като LARGE протеини. Специфични варианти на гените, кодиращи тези протеини, изглежда са под положителна селекция в Западна Африка, където LASV е ендемичен.[21] Алфа-дистрогликанът също се използва като рецептор от аренавирусите от новия свят (Oliveros и Latino вируси). За разлика от това, аренавирусите от Новия свят, които включват важните вируси Machupo, Guanarito, Junin и Sabia в допълнение към непатогенния вирус Amapari, използват рецептора за трансферин 1 . Малка алифатна аминокиселина в GP1 гликопротеин аминокиселинна позиция 260 е необходима за свързване с висок афинитет към алфа-DG. В допълнение, GP1 аминокиселинна позиция 259 също изглежда важна, тъй като всички аренавируси, показващи висок афинитет на алфа-DG свързване, притежават обемна ароматна аминокиселина (тирозин или фенилаланин) в тази позиция.
За разлика от повечето вируси с обвивка, които използват покрити с клатрин вдлъбнатини за навлизане в клетката и се свързват с техните рецептори по рН-зависим начин, Lassa и вирусът на лимфоцитен хориоменингит (LCMV) вместо това използват ендоцитозен път, независим от клатрин, кавеолин, динамин и актин. Веднъж попаднали в клетката, вирусите се доставят бързо до ендозоми чрез везикуларен трафик, макар и такъв, който е до голяма степен независим от малките GTPases Rab5 и Rab7 . При контакт с ендозома рН-зависимо мембранно сливане възниква, медиирано от гликопротеина на обвивката, който при по-ниско рН на ендозома свързва лизозомния протеин LAMP1, което води до мембранно сливане и излизане от ендозома.[22]
Жизнен цикъл
[редактиране | редактиране на кода]
Жизненият цикъл на Lassa mammarenavirus е подобен на аренавирусите от Стария свят. Lassa mammarenavirus навлиза в клетката чрез рецептор-медиирана ендоцитоза. Все още не е известно кой ендоцитозен път се използва, но поне клетъчното влизане е чувствително към изчерпването на холестерола. Смята се, че интернализацията на вируса е ограничена при изчерпване на холестерола. Рецепторът, използван за навлизане в клетката, е алфа-дистрогликан, силно еволюционно запазен и повсеместно експресиран рецептор на клетъчната повърхност за протеини на извънклетъчния матрикс. Дистрогликанът, който по-късно се разцепва на алфа-дистрогликан и бета-дистрогликан, първоначално се експресира в повечето клетки до зрели тъкани и осигурява молекулярна връзка между ECM и базирания на актин цитоскелет.[23] След като вирусът навлезе в клетката чрез медиирана от алфа-дистрогликан ендоцитоза, средата с ниско рН задейства рН-зависимо мембранно сливане и освобождава RNP (вирусен рибонуклеопротеин) комплекс в цитоплазмата. Вирусната РНК се разопакова и репликацията и транскрипцията започват в цитоплазмата.[23] Когато репликацията започне, S и L РНК геномите синтезират антигеномните S и L РНК, а от антигеномните РНК се синтезират геномни S и L РНК. Както геномните, така и антигеномните РНК са необходими за транскрипция и транслация. S РНК кодира GP и NP (вирусен нуклеокапсиден протеин) протеини, докато L РНК кодира Z и L протеини. L протеинът най-вероятно представлява вирусната РНК-зависима РНК полимераза.[24] Когато клетката е заразена от вируса, L полимеразата се свързва с вирусния RNP и инициира транскрипцията на геномната РНК. 5' и 3' крайните 19 nt вирусни промоторни региони на двата РНК сегмента са необходими за разпознаване и свързване на вирусната полимераза. Първичната транскрипция първо транскрибира иРНК от геномните S и L РНК, които кодират съответно NP и L протеини. Транскрипцията завършва при структурата на стволовата бримка (SL) в рамките на междугеномната област. Аренавирусите използват стратегия за „изтръгване на шапката“, за да получат структурите на капачката от клетъчните иРНК и тя се медиира от ендонуклеазната активност на L полимеразата и активността на свързване на капачката на NP. Антигеномната РНК транскрибира вирусни гени GPC и Z, кодирани в геномна ориентация, съответно от S и L сегменти. Антигеномната РНК също служи като матрица за репликацията.[25] След транслация на GPC, той се модифицира посттранслационно в ендоплазмения ретикулум. GPC се разцепва на GP1 и GP2 на по-късния етап от секреторния път. Съобщава се, че клетъчната протеаза SKI-1/S1P е отговорна за това разцепване. Разцепените гликопротеини се включват в обвивката на вириона, когато вирусът пъпчи и се освобождава от клетъчната мембрана.[24]
Патогенеза
[редактиране | редактиране на кода]
LASV причинява Ласа треска. Първоначалните симптоми включват грипоподобно заболяване, характеризиращо се с висока температура, обща слабост, кашлица, болки в гърлото, главоболие и стомашно-чревни прояви. По-късните хеморагичните прояви включват съдова пропускливост.[25]
При навлизането на LASV в нов гостоприемник, вирусът заразява почти всяка тъкан в човешкото тяло, започвайки от лигавицата, червата, белите дробове и пикочната система, след което преминава към съдовата система.[6]
Основните цели на вируса са антиген-представящи клетки, главно дендритни клетки и ендотелни клетки.[26][27][28] През 2012 г. беше съобщено как нуклеопротеинът (NP) на Lassa mammarenavirus саботира вродената имунна система на гостоприемника. Обикновено, когато патоген навлезе в гостоприемника, вродената защитна система разпознава свързаните с патогена молекулярни модели (PAMP) и активира имунен отговор. Един от механизмите открива двойноверижна РНК (dsRNA), която се синтезира само от вируси с отрицателен смисъл. В цитоплазмата dsRNA рецепторите, като RIG-I (ген I, индуцируем от ретиноева киселина) и MDA-5 (ген 5, свързан с диференциация на меланома), откриват dsRNAs и инициират сигнални пътища, които транслокират IRF-3 (интерферон регулаторен фактор 3) и други транскрипционни фактори към клетъчното ядро. Транслокираните транскрипционни фактори активират експресията на интерферони 𝛂 и 𝛃 и те инициират адаптивен имунитет. NP, кодиран от Lassa mammarenavirus, е от съществено значение за вирусната репликация и транскрипция, но също така потиска вродения IFN отговор на гостоприемника чрез инхибиране на транслокацията на IRF-3. Съобщава се, че NP на Lassa mammarenavirus има екзонуклеазна активност само към dsRNA.[29] екзонуклеазната активност на NP dsRNA противодейства на отговорите на IFN чрез смилане на PAMP, като по този начин позволява на вируса да избегне имунните отговори на гостоприемника.[30]
Източници
[редактиране | редактиране на кода]- ↑ а б Asogun DA, Günther S, Akpede GO, Ihekweazu C, Zumla A. Lassa Fever: Epidemiology, Clinical Features, Diagnosis, Management and Prevention. Infect Dis Clin North Am. 2019 Dec;33(4):933-951. doi: 10.1016/j.idc.2019.08.002. PMID: 31668199.
- ↑ а б Garry RF. Lassa fever - the road ahead. Nat Rev Microbiol. 2023 Feb;21(2):87-96. doi: 10.1038/s41579-022-00789-8. Epub 2022 Sep 12. PMID: 36097163; PMCID: PMC9466315.
- ↑ Sogoba N, Feldmann H, Safronetz D (September 2012). "Lassa fever in West Africa: evidence for an expanded region of endemicity". Zoonoses and Public Health. 59 Suppl 2 (59): 43–7. doi:10.1111/j.1863-2378.2012.01469.x
- ↑ Salami K, Gouglas D, Schmaljohn C, Saville M, Tornieporth N. A review of Lassa fever vaccine candidates. Curr Opin Virol. 2019 Aug;37:105-111. doi: 10.1016/j.coviro.2019.07.006. Epub 2019 Aug 28. PMID: 31472333.
- ↑ Sulis G, Peebles A, Basta NE. Lassa fever vaccine candidates: A scoping review of vaccine clinical trials. Trop Med Int Health. 2023 Jun;28(6):420-431. doi: 10.1111/tmi.13876. Epub 2023 Apr 24. PMID: 37095630; PMCID: PMC10247453.
- ↑ а б The Lassa Ward:One Man's Fight Against One of the World's Deadliest Diseases. St. Martin's Press, 2009. ISBN 978-0-312-37700-7.
- ↑ Lassa Fever | CDC // www.cdc.gov. Посетен на 2016-09-23.
- ↑ Lassa fever, a new virus disease of man from West Africa. I. Clinical description and pathological findings // The American Journal of Tropical Medicine and Hygiene 19 (4). July 1970. DOI:10.4269/ajtmh.1970.19.670. с. 670–6.
- ↑ The story of Lassa fever. Part I: Discovering the disease // New York State Journal of Medicine 92 (5). May 1992. с. 199–202.
- ↑ а б Encyclopedia of Global Health. Т. 1. SAGE, 9 January 2008. ISBN 978-1-4129-4186-0. OCLC 775277696. с. 354.
- ↑ Isolation and antigenic characterization of Lassa virus // Nature 227 (5254). July 1970. DOI:10.1038/227174a0. с. 174.
- ↑ Sonja Buckley // Lancet 365 (9463). 2005-03-12. DOI:10.1016/S0140-6736(05)71068-0. с. 932.
- ↑ Lassa fever in the Eastern Province of Sierra Leone, 1970-1972. I. Epidemiologic studies // The American Journal of Tropical Medicine and Hygiene 23 (6). November 1974. DOI:10.4269/ajtmh.1974.23.1131. с. 1131–9.
- ↑ Lassa fever in the Eastern Province of Sierra Leone, 1970-1972. II. Clinical observations and virological studies on selected hospital cases // The American Journal of Tropical Medicine and Hygiene 23 (6). November 1974. DOI:10.4269/ajtmh.1974.23.1140. с. 1140–9.
- ↑ а б Multifunctional nature of the arenavirus RING finger protein Z // Viruses 4 (11). November 2012. DOI:10.3390/v4112973. с. 2973–3011.
- ↑ Jamie Dyal and Ben Fohner Lassa virus Stanford University Humans and Viruses Class of 2005
- ↑ Lashley, Felissa R., and Jerry D. Durham. Emerging Infectious Diseases: Trends and Issues. New York: Springer Pub., 2002. Print.
- ↑ Klitting R, Mehta SB, Oguzie JU, Oluniyi PE, Pauthner MG, Siddle KJ, Andersen KG, Happi CT, Sabeti PC. Lassa Virus Genetics. Curr Top Microbiol Immunol. 2023;440:23-65. doi: 10.1007/82_2020_212. PMID: 32418034.
- ↑ Genetic diversity among Lassa virus strains // Journal of Virology 74 (15). August 2000. DOI:10.1128/JVI.74.15.6992-7004.2000. с. 6992–7004.
- ↑ Identification of alpha-dystroglycan as a receptor for lymphocytic choriomeningitis virus and Lassa fever virus // Science 282 (5396). December 1998. DOI:10.1126/science.282.5396.2079. с. 2079–81.
- ↑ Endemic: MedlinePlus Medical Encyclopedia
- ↑ Loureiro ME, D'Antuono A, López N. Virus⁻Host Interactions Involved in Lassa Virus Entry and Genome Replication. Pathogens. 2019 Jan 29;8(1):17. doi: 10.3390/pathogens8010017. PMID: 30699976; PMCID: PMC6470645.
- ↑ а б Cell entry by human pathogenic arenaviruses // Cellular Microbiology 10 (4). April 2008. DOI:10.1111/j.1462-5822.2007.01113.x. с. 828–35.
- ↑ а б Molecular diagnostics of viral hemorrhagic fevers // Antiviral Research 57 (1–2). January 2003. DOI:10.1016/s0166-3542(02)00201-2. с. 61–87.
- ↑ а б Pathogenesis of Lassa fever // Viruses 4 (10). October 2012. DOI:10.3390/v4102031. с. 2031–48.
- ↑ The use of a calcium-channel blocker, nicardipine, for severely asphyxiated newborn infants // Developmental Medicine and Child Neurology 32 (7). July 1990. DOI:10.1111/j.1469-8749.1990.tb08540.x. с. 567–74.
- ↑ Cutting edge: impairment of dendritic cells and adaptive immunity by Ebola and Lassa viruses // Journal of Immunology 170 (6). March 2003. DOI:10.4049/jimmunol.170.6.2797. с. 2797–801.
- ↑ Lassa virus infection of human dendritic cells and macrophages is productive but fails to activate cells // Journal of Immunology 172 (5). March 2004. DOI:10.4049/jimmunol.172.5.2861. с. 2861–9.
- ↑ Structural basis for the dsRNA specificity of the Lassa virus NP exonuclease // PLOS ONE 7 (8). Aug 2012. DOI:10.1371/journal.pone.0044211. с. e44211.
- ↑ Hiding the evidence: two strategies for innate immune evasion by hemorrhagic fever viruses // Current Opinion in Virology 2 (2). April 2012. DOI:10.1016/j.coviro.2012.01.003. с. 151–6.
| Тази страница частично или изцяло представлява превод на страницата Lassa mammarenavirus в Уикипедия на английски. Оригиналният текст, както и този превод, са защитени от Лиценза „Криейтив Комънс – Признание – Споделяне на споделеното“, а за съдържание, създадено преди юни 2009 година – от Лиценза за свободна документация на ГНУ. Прегледайте историята на редакциите на оригиналната страница, както и на преводната страница, за да видите списъка на съавторите.
ВАЖНО: Този шаблон се отнася единствено до авторските права върху съдържанието на статията. Добавянето му не отменя изискването да се посочват конкретни източници на твърденията, които да бъдат благонадеждни. |