Мангано-цинков елемент

Мангано-цинковият елемент (също цинково-въглеродна батерия или суха батерия), също известен като елемент на Лекланше, е първичен химичен източник на ток, в който катодът е манганов диоксид (MnO2, пиролузит) в смес с графит (около 9,5%), електролитът е разтвор на амониев хлорид (NH4Cl), а анодът е от метален цинк (Zn).
Това е най-известният първичен захранващ елемент (химичен източник на ток за еднократно използване), който днес широко се използва в преносими устройства. В началото тези елементи са се запълвали с течен електролит. По-късно електролитът е сгъстяван с нишестени вещества – това позволило захранващите елементи да станат по-практични, наричат ги „сухи“, в които възможността електролитът да изтече е сведена до минимум. За разлика от алкалния елемент, в който като електролит се използва основата KOH, мангано-цинковият елемент е со̀лен, тъй като в него като електролит се използва сол – амониев хлорид.
История
[редактиране | редактиране на кода]Първият мангано-цинков елемент е направен от Жорж Лекланше през 1865 г.[1].
Характеристики
[редактиране | редактиране на кода]- Теоретична енергоемкост:
- Специфична енергоемкост: 67 – 99 W∙h/kg
- Специфична енергоплътност: 122 – 263 W∙h/dm³.
- ЕДС: 1,51 V.
- Работна температура: от −40 до +55 °C.
Принцип на действие
[редактиране | редактиране на кода]При черпене на ток електроните постъпват през външната електрическа верига от цинковия електрод на въгленовата (графитна) пръчка. Настъпват следните реакции:
Анод: Zn → Zn 2+ + 2e−
На въгленовата пръчка електроните служат за възстановяване на H3O+-йоните:
Катод: 2H3O+ + 2e− → H2 + 2H2O
Йоните H3O+ се образуват в резултат на частична протолиза на NH4+-йоните на електролита:
NH4+ + H2O ↔ H3O+ + NH3
При възстановяване на H3O+-йоните се образува водород, който не може да се отдели (корпусът е херметичен) и образува около графитната пръчка прослойка от газ (електрохимична поляризация на въгленовия електрод). Токът бавно спира. За да се избегне образуването на водород, графитният електрод се обгръща със слой манганов диоксид (MnO2). В присъствието на манганов диоксид H3O+-йоните се възстановяват с образуване на вода:
2MnO2 + 2H3O+ + 2e− → 2MnO (OH) + 2H2O
По този начин се избягва поляризацията на електрода, а мангановият диоксид се нарича деполяризатор.
Електролитът NH4Cl се дисоциира и частично се протолизира. Най-общо:
2NH4Cl + 2H2O ↔ 2NH3 + 2H3O+ + 2Cl−
Образуващите се на анода йони Zn2+ постъпват в разтвора и образуват трудноразтворима сол:
Zn2+ + 2NH3 + 2Cl− → [Zn (NH3)2]Cl2
Общо:
Анод: Zn – 2e− → Zn2+ Катод: 2MnO2 + 2H3O+ + 2e− → 2MnO (OH) + 2H2O Раствор електролита: Zn2+ + 2NH4+ + 2Cl− + 2H2O ↔ [Zn (NH3)2]Cl2 + 2H3O+
Обща реакция: Zn + 2MnO2 + 2NH4Cl → 2MnO (OH) + [Zn (NH3)2]Cl2 По време на разреждането цинковата чашка (цинковият цилиндър) постепенно се разтваря. За да се избегне изтичане на електролита или на продуктите от реакцията цинковата чашка има запас по дебелина или е обхваната от желязна защитна обвивка.
Устройство
[редактиране | редактиране на кода]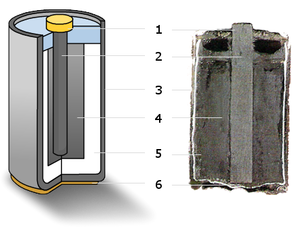
(1) – метално калпаче,
(2) – графитен електрод („+“),
(3) – цинкова чаша („—“),
(4) – манганов диоксид,
(5) – електролит,
(6) – метален контакт
За електроди в „сухия елемент“ служат цинковата чашка и графитната пръчка. Затова сухият елемент се нарича още въглено-цинков елемент. Положителен електрод е въгленовата пръчка, отрицателен – цинковият цилиндър. Въгленовата пръчка е обкръжена от смес на манганов диоксид (MnO2) и въглен (сажди). Като електролит служи разтвор на амониев хлорид (NH4Cl) с малка добавк на цинков хлорид (ZnCl2), сгъстен с нишесте и брашно, за да не може електролитът да изтече или изсъхне при съхранение и експлоатация на елемента.

-
Цинковата чашка („-“ електрод) е частично разтворена, под нея има книжна обвивка, просмукана с електролит и залята с битумна паста
-
Цинковата чашка е отстранена, въгленовата пръчка („+“ електрод) със запресованото („+“ контакт) капаче, е демонтирана
-
Книжната чашка е пълна с пресован мангано-графитен прах с канал за „+“ електрода
Области на използване
[редактиране | редактиране на кода]Всички първични източници на ток, с изключение на сребърно-цинковия, имат голямо вътрешно съпротивление – десетки ома, като по тази причина не допускат разряд с токове с голяма сила вследствие големия пад на напрежението върху вътрешното съпротивление. То да се има предвид при използването им като силови източници на ток.
Най-ефективна област на използване на мангано-цинковите батерии са уредите със средно и ниско енергопотребление, например фенерчета, челници, пултове за дистанционно управление и часовници.
Източници
[редактиране | редактиране на кода]Литература
[редактиране | редактиране на кода]- Кромптон Первичные источники тока = Small Batteries. Volume 2. Primary Cells. T. R. Crompton. The Macmillan Press Ltd., London, Basingstocke. 1982.
- ГОСТ Р МЭК 60086-1-2010 Батареи первичные. Часть 1. Общие требования
- ГОСТ 15596 – 82 Источники тока химические. Термины и определения
Външни препратки
[редактиране | редактиране на кода]- Марганцево-цинковые батарейки // (на руски)
- Батарея электропитания // (на руски)



