Осмотично налягане
Осмотично налягане е минималното налягане, което трябва да бъде приложено към разтвор, за да се предотврати вътрешния поток на чистия му разтворител през полупропусклива мембрана.[1] Може да се определи и като мярка за склонност на разтвор да приеме чист разтворител чрез осмоза. Потенциално осмотично налягане се нарича максималното осмотично налягане, което може да се развие в разтвор, ако той е бил отделен от чистия си разтворител чрез избирателно пропусклива мембрана. Феноменът на осмозата възниква от склонността на чист разтворител да премине през полупропусклива мембрана в разтвора, съдържащ разтворимо вещество, за което мембрана е непропусклива. Този процес е изключително важен в биологията, тъй като клетъчната мембрана е полупропусклива.
Общ преглед
[редактиране | редактиране на кода]

За да се визуализира този ефект, можем да си представим U-образна тръба с еднакво количество вода от всяка страна, разделена с водопропусклива мембрана в основата си, която е непропусклива за молекули на захарта. От едната страна се добавя захар във водата. Височината на колоната течност от въпросната страна ще нарасне (а тази от другата страна ще спадне), пропорционално на налягането на двата разтвора, поради движението на чиста вода от отделението без захар към отделението, съдържащо захарна вода. Този процес ще спре веднъж, щом налягането на водата от двете страни на мембраната се изравни.[2]
Якоб Вант Хоф за пръв път предлага „закон“, който описва отношението на осмотичното налягане с концентрацията на разтворими вещества:
където е осмотично налягане, i е безразмерен фактор на Вант Хоф, който се отнася за разтворимите вещества, Mрв е моларната концентрация на разтворимите вещества, R е газовата константа, а T е температурата в келвини. Тази формула важи тогава, когато концентрацията на разтворими вещества е достатъчно ниска, че разтворът да може да се счита за идеален. Пропорционалността с концентрацията означава, че осмотичното налягане е колигативно свойство. Може да бъде забелязана приликата на тази формула с уравнението на състоянието на идеалния газ под формата , където n е броят молове газови молекули в обем V, а n/V е моларната концентрация на газовите молекули.
Вант Хоф е първият лауреат на Нобелова награда за химия за работата си по осмотичното налягане и химичното равновесие.
Просто разширение на това уравнение е предложено от Хармън Нортръп Морс:[3][4]
- ,
където молални, m, единици на концентрация се използват вместо моларност. Тази формула разширява обхвата на приложимост на измерванията на осмотично налягане към по-концентрирани разтвори. Въпреки това, тя все още е ограничена. При много високи концентрации законът на Вант Хоф не важи – осмотичното налягане на разтвора клони към безкрайност, когато процентът на разтворителя клони към нула, докато осмотичното налягане, изчислявано от уравнението на Вант Хоф, никога не преминава няколкостотин атмосфери, докато при приближаване на условията на чисто разтворимо вещество. От друга страна, законът на Морс при по-високи концентрации дава далеч по-високо осмотично налягане, от това, които съществува реално.[4]
Възможно е и по-нататъшно разширение на концентрационния обхват и точност на изчисленията на осмотично налягане, което се извежда така:
,
където молалните единици се заменят с отрицателен естествен логаритъм от активността на разтворителя, aраз, делено на моларния обем на разтворителя, V°.
В исторически план, законът на Вант Хоф за измерване на осмотичното налягане се използва за определяне на молекулна маса. Клетката на Пфефер е разработена за измерването на осмотичното налягане в биологията.
Приложение
[редактиране | редактиране на кода]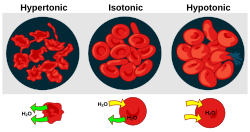
Осмотичното налягане е важен фактор, засягащ клетките. Осморегулацията е хомеостазисен механизъм на организма за постигане на баланс на осмотичното налягане.
- Хипертоничността е наличието на разтвор, който кара клетките да се свиват.
- Хипотоничността е наличието на разтвор, който кара клетките да се разширяват.
- Изотоничността е наличието на разтвор, който не води до промяна в обема на клетките.
Когато биологична клетка се намира в хипотонична среда, вътрешността на клетката събира вода, водата преминава през клетъчната мембрана в клетката, което я кара да се разшири. При растителните клетки клетъчната стена ограничава разширението, което води до налягане върху клетъчната стена отвътре, познато под името тургор. Тургорът позволява на тревистите растения да стоят изправени. Той също е и решаващ фактор за това как растенията регулират отворите на своите устица. При животинските клетки повишеното осмотично налягане може да доведе до цитолиза.
Осмотичното налягане е в основата на филтрирането (обратна осмоза), което се използва широко за пречистване на водата. Водата за пречистване се поставя в камера и се подлага на налягане, което е по-голямо от осмотичното налягане на водата и разтворените в нея вещества. Част от камерата се отваря към диференциално проницаема мембрана, която пропуска водните молекули, но не и разтворените частици. Осмотичното налягане на океанската вода е около 27 атмосфери. Обратната осмоза обезсолява морската вода.
Извеждане на формулата на Вант Хоф
[редактиране | редактиране на кода]В система, която е постигнала равновесие, химичният потенциал на разтворителя от двете страни на мембраната е равен. Отделението, съдържащо чист разтворител, има химичен потенциал от , където е налягането. В другото отделение химичният потенциал на разтвора, съдържащ разтворими вещества, зависи от моларната част на разтворителя, . Това отделение може да има различно налягане, . Следователно химичният потенциал на разтворителя може да бъде записан като . Ако , то балансът на химичния потенциал е
- .
Тук разликата в налягането на двете отделения се определя като осмотичното налягане, упражнявано от разтворените вещества. Държейки налягането, добавянето на разтворими вещества намалява химичния потенциал (ентропичен ефект). Следователно, налягането на разтвора трябва да бъде повишено с цел да се компенсира загубата на химичен потенциал.
За да се намери (осмотичното налягане), трябва да се счита равновесие между разтвор, съдържащ разтворени частици, и чиста вода.
- .
Лявата страна може да бъде записана като:
- ,
където е коефициентът на активност на разтворените вещества. Произведението също е познато като активността на разтворителя, което за вода е . Добавянето на налягане се изразява чрез израза за енергия на разширяване:
- ,
където е моларният обем (m³/mol). Вмъквайки израза по-горе в уравнението за химичен потенциал на цялата система и преподреждайки го, се получава:
- .
Ако течността е несвиваема, моларният обем е константа, , а интегралът става . Така се получава
- .
Коефициентът на активност е функция от концентрацията и температурата, но в случая на разредени смеси, той е много близък до 1, така че
- .
За водни разтвори на соли, йонизацията трябва да бъде взета предвид. Например, 1 мол NaCl се йонизира до 2 мола йони.
Неидеални разтвори
[редактиране | редактиране на кода]Общо разширение на уравнението на Вант Хоф използва вириално разлагане. За идеален газ, то има вида
където B, C ... са вириални коефициенти. Подобен израз се прилага за осмотичното налягане с вместо налягане, p. Определянето на вириалните коефициенти от осмотичните коефициенти е основата за определяне на параметрите на Пицер, които се използват за количествено измерване на неидеалното поведение на разтвори от йонни и други разтворени вещества.
Източници
[редактиране | редактиране на кода]- ↑ Voet, Donald. Fundamentals of Biochemistry. Rev. New York, Wiley, 2001. ISBN 978-0-471-41759-0. с. 30.
- ↑ Atkins, Peter W. Section 5.5 (e) // Physical Chemistry. 9th. Oxford University Press, 2010. ISBN 978-0-19-954337-3.
- ↑ Applied Physical Pharmacy. McGraw-Hill Professional, 2002. ISBN 0-07-135076-4. с. 54 – 57.
- ↑ а б Lewis, Gilbert Newton. THE OSMOTIC PRESSURE OF CONCENTRATED SOLUTIONS, AND THE LAWS OF THE PERFECT SOLUTION. // Journal of the American Chemical Society 30 (5). 1 май 1908. DOI:10.1021/ja01947a002. с. 668 – 683.


























