Арени: Разлика между версии
LordBumbury (беседа | приноси) м °C |
м интервал след запетая; козметични промени |
||
| Ред 1: | Ред 1: | ||
[[ |
[[Файл:Benzene circle.svg|мини|100px|Бензеновият пръстен]] |
||
'''Ароматен въглеводород''' или '''арен'''<ref>Definition IUPAC [[Gold Book]] [http://www.iupac.org/goldbook/A00435.pdf Link]</ref> (понякога арилов въглеводород)<ref>[http://diss.kib.ki.se/2003/91-7349-549-2/thesis.pdf Mechanisms of Activation of the Aryl Hydrocarbon Receptor] by Maria Backlund, Institute of Environmental Medicine, Karolinska Institutet</ref> е [[въглеводород]] с циклична структура и делокализиран [[π-електронен секстет]]. Терминът ''ароматни'' е предложен преди определянето на физическия механизъм за ароматност и произлиза от факта, че много от тези съединения имат сладникав [[аромат]]. [[Конфигурация]]та на шестте [[въглерод]]ни атома в ароматните съединения е известна като ''пръстен на [[бензен]]а'', по името на възможно най-простия въглеводород, бензена (''ост.'' бензол). Ароматните въглеводороди могат да бъдат моноциклични или полициклични. |
'''Ароматен въглеводород''' или '''арен'''<ref>Definition IUPAC [[Gold Book]] [http://www.iupac.org/goldbook/A00435.pdf Link]</ref> (понякога арилов въглеводород)<ref>[http://diss.kib.ki.se/2003/91-7349-549-2/thesis.pdf Mechanisms of Activation of the Aryl Hydrocarbon Receptor] by Maria Backlund, Institute of Environmental Medicine, Karolinska Institutet</ref> е [[въглеводород]] с циклична структура и делокализиран [[π-електронен секстет]]. Терминът ''ароматни'' е предложен преди определянето на физическия механизъм за ароматност и произлиза от факта, че много от тези съединения имат сладникав [[аромат]]. [[Конфигурация]]та на шестте [[въглерод]]ни атома в ароматните съединения е известна като ''пръстен на [[бензен]]а'', по името на възможно най-простия въглеводород, бензена (''ост.'' бензол). Ароматните въглеводороди могат да бъдат моноциклични или полициклични. |
||
| Ред 5: | Ред 5: | ||
* Моноядрени арени |
* Моноядрени арени |
||
Моноядрените арени са изградени от едно бензеново ядро ([[ |
Моноядрените арени са изградени от едно бензеново ядро ([[Файл:Benzol.svg|20px]]). Това са бензенът и неговите хомолози. |
||
[[ |
[[Файл:Hexa-peri-hexabenzocoronene-3D-spacefill.png|мини|Хекса-пери-хексабензокоронен]] |
||
* Полиядрени арени |
* Полиядрени арени |
||
| Ред 17: | Ред 17: | ||
== Бензен и производните му == |
== Бензен и производните му == |
||
[[ |
[[Файл:Ortho-meta-para.svg|мини|200px|Орто-, мета-, и пара-ориентация при бензен]] |
||
Бензеновите производни имат между един и шест заместители, свързани към централното ядро. Примери на бензенови производни само с един заместител са [[фенол]]ът, който носи хидроксилна група, и [[толуен]]ът с метилова група. Когато има повече от един заместител в пръстена, тяхната пространствена ориентация стават важна, като се делят на ''орто-'', ''мета-'', и ''пара-'' ориентирани. Така например, при трите изомера за [[крезол]]а, метилова и хидроксилна групи може да бъдат поставени в непосредствена близост една от друга (''орто''), през една позиция (''мета'') или една срещу друга (''пара''). [[Ксиленол]]ът има две метилови групи в допълнение към хидроксилната група и за тази структура съществуват 6 изомера. |
Бензеновите производни имат между един и шест заместители, свързани към централното ядро. Примери на бензенови производни само с един заместител са [[фенол]]ът, който носи хидроксилна група, и [[толуен]]ът с метилова група. Когато има повече от един заместител в пръстена, тяхната пространствена ориентация стават важна, като се делят на ''орто-'', ''мета-'', и ''пара-'' ориентирани. Така например, при трите изомера за [[крезол]]а, метилова и хидроксилна групи може да бъдат поставени в непосредствена близост една от друга (''орто''), през една позиция (''мета'') или една срещу друга (''пара''). [[Ксиленол]]ът има две метилови групи в допълнение към хидроксилната група и за тази структура съществуват 6 изомера. |
||
| Ред 41: | Ред 41: | ||
== Ароматност == |
== Ароматност == |
||
=== Правило на Хюкел за ароматност === |
=== Правило на Хюкел за ароматност === |
||
През 1931 г. [[Ерих Хюкел]] извежда т.нар. '''4n+2 правило'''. То гласи, че плоските циклични спрегнати системи са '''ароматни''', ако имат (4n+2) π-електрона (n=1,2,3...), и '''неароматни''', ако имат 4n π-електрона в пръстена. Бензенът има 4n+2=6 π-електрона (n=1) и е ароматен. [[Циклобутадиен]]ът има 4 π-електрона (n=1) и е антиароматен (крайно неустойчив, получен 1965 г. при -78 |
През 1931 г. [[Ерих Хюкел]] извежда т.нар. '''4n+2 правило'''. То гласи, че плоските циклични спрегнати системи са '''ароматни''', ако имат (4n+2) π-електрона (n=1,2,3...), и '''неароматни''', ако имат 4n π-електрона в пръстена. Бензенът има 4n+2=6 π-електрона (n=1) и е ароматен. [[Циклобутадиен]]ът има 4 π-електрона (n=1) и е антиароматен (крайно неустойчив, получен 1965 г. при -78 °C и веднага се [[Димеризация|димеризира]]). Следователно наличието на циклична (затворена) спрегната π-система е необходимо, но не е единствено условие за ароматност.<ref name=":0">Марко Кирилов, Георги Нейков и др. – Химия и опазване на околната среда – профилирана подготовка 12. клас – Булвест 2000 – София 2007 – ISBN 978-954-18-0366-0</ref> За да бъде едно съединение ароматно, е необходимо да се спази преди всичко и правилото на Хюкел. Правилото обобщено гласи, че в молекулата на съединението трябва:<ref name="Петров">„Органична химия“, Галин Петров, УИ „Св. Климент Охридски“, София, 2006, ISBN-10: 954-07-2382-5</ref> |
||
# да се съдържат атоми, свързани в пръстен (като освен C-атоми в пръстена могат да участват и други атоми – [[хетероциклични съединения]]); |
# да се съдържат атоми, свързани в пръстен (като освен C-атоми в пръстена могат да участват и други атоми – [[хетероциклични съединения]]); |
||
# броят на π-електроните от нехибридните p-AO в пръстена да са равни на 4''n''+2 (Хюкел), като ''n''=0, 1, 2, 3 и т.н.; |
# броят на π-електроните от нехибридните p-AO в пръстена да са равни на 4''n''+2 (Хюкел), като ''n''=0, 1, 2, 3 и т.н.; |
||
| Ред 47: | Ред 47: | ||
Просто казано едно циклично съединение е ароматно, ако в пръстена му се редуват двойни и прости връзки и ако съдържа 2, 6, 10, 14, 18 или 26... наброй π-електрони в него: |
Просто казано едно циклично съединение е ароматно, ако в пръстена му се редуват двойни и прости връзки и ако съдържа 2, 6, 10, 14, 18 или 26... наброй π-електрони в него: |
||
* '''2''' (n=0 при [[циклопропенилиев катион]] -[[Файл:Cyclopropenyl Cation.jpg| |
* '''2''' (n=0 при [[циклопропенилиев катион]] -[[Файл:Cyclopropenyl Cation.jpg|безрамка|46x46px]]) |
||
* '''6''' (n=1 при бензен – [[Файл:Benzol.svg| |
* '''6''' (n=1 при бензен – [[Файл:Benzol.svg|безрамка|36x36px]], [[пирол]] [[Файл:Pyrrole structure.png|безрамка|52x52px]]и циклопентадиенилнатрий – виж долу) |
||
* '''10''' (n=2 при [[нафтален]] – [[Файл:Naftalen.svg| |
* '''10''' (n=2 при [[нафтален]] – [[Файл:Naftalen.svg|безрамка|52x52px]]) |
||
* '''14''' (n=3 при [[антрацен]] – [[Файл:Anthracen.svg| |
* '''14''' (n=3 при [[антрацен]] – [[Файл:Anthracen.svg|безрамка|78x78px]] и [[фенантрен]] – [[Файл:Fenantrene.svg|безрамка|49x49px]]) |
||
* '''18''' (n=4 при [[анулен]] – [[Файл:(18)Annulene.svg| |
* '''18''' (n=4 при [[анулен]] – [[Файл:(18)Annulene.svg|безрамка|57x57px]]) |
||
* '''26''' (n=6 при [[хем]]ът на [[хемоглобин]]а) са с '''ароматни свойства''' и са [[Компланарност|копланарни]]. Това правило е потвърдено с многобройни синтезирани за целта съединения, но има и такива, които не отговарят на правилото, а имат ароматен характер, напр. [[пирен]].<ref name=":1">М. Николов и др. – Учебник по Химия за студенти по медицина и стоматология – Трето издание – АРСО София 2012 – ISBN: 978-954-8967-26-Х</ref> |
* '''26''' (n=6 при [[хем]]ът на [[хемоглобин]]а) са с '''ароматни свойства''' и са [[Компланарност|копланарни]]. Това правило е потвърдено с многобройни синтезирани за целта съединения, но има и такива, които не отговарят на правилото, а имат ароматен характер, напр. [[пирен]].<ref name=":1">М. Николов и др. – Учебник по Химия за студенти по медицина и стоматология – Трето издание – АРСО София 2012 – ISBN: 978-954-8967-26-Х</ref> |
||
Ако пръстеновидно съединение има нечетен брой редуващи се двойни връзки, то най-вероятно е ароматно. |
Ако пръстеновидно съединение има нечетен брой редуващи се двойни връзки, то най-вероятно е ароматно. |
||
| Ред 57: | Ред 57: | ||
=== Примери за други ароматни съединения === |
=== Примери за други ароматни съединения === |
||
==== Циклопентадиенилнатрии ==== |
==== Циклопентадиенилнатрии ==== |
||
[[Файл:Sodium_cyclopentadienide-B.gif|link=https://bg.wikipedia.org/wiki/Файл:Sodium_cyclopentadienide-B.gif| |
[[Файл:Sodium_cyclopentadienide-B.gif|link=https://bg.wikipedia.org/wiki/Файл:Sodium_cyclopentadienide-B.gif|мини|155x155px|Структура на циклопентадиенилнатрии]] |
||
От [[циклопентадиен]] след изместване водороден атом от метиленовата си група с [[Натрий]] се получава '''циклопентадиенилнатрий''', в пръстена на който се съдържат 6 спрегнати π-електрона (4x1+2 = 6), което го прави ароматно съединение. <ref name=":1" /> |
От [[циклопентадиен]] след изместване водороден атом от метиленовата си група с [[Натрий]] се получава '''циклопентадиенилнатрий''', в пръстена на който се съдържат 6 спрегнати π-електрона (4x1+2 = 6), което го прави ароматно съединение. <ref name=":1" /> |
||
==== Фероцен ==== |
==== Фероцен ==== |
||
[[Файл:Fe-2Cp_schraeg.png|link=https://bg.wikipedia.org/wiki/Файл:Fe-2Cp_schraeg.png| |
[[Файл:Fe-2Cp_schraeg.png|link=https://bg.wikipedia.org/wiki/Файл:Fe-2Cp_schraeg.png|ляво|мини|Структурна формула на '''фероцен''']] |
||
Водороден атом може да се замести и с халогенмагнезилна група като напр. C<sub>2</sub>H<sub>5</sub>MgBr. Продукт на реакцията е циклопентадиенилмагнезиев бромид, който реагира с [[железен дихлорид]] и дава кристалното съединение '''бис-циклопентадиенилжелязо''' (портокалев цвят) наречено [[Фероцен|'''фероцен''']] от [[Роберт Удуърт]]. Фероценът съдържа два петатомни пръстена, изградени от СН-групи. Във всеки от тях четирите π-електрона от π-връзките и двойката електрони от аниона на СН-групата (произлязла, от СН<sub>2</sub>-групата) образуват общ π-секстет. Така фероценът има два π-секстета и притежава ароматен характер (подобно на бензена). Двете ядра са копланарни. Железният атом в това съединение е свързан с петте C-атома на всеки от пръстените подобно на сандвич. „Сандвичевата“ структура на фероцена е потвърдена по рентгенографски път. Фероценът може да реагира с ацетилхлорид, като дава диацетилно производно (синтез по Фридел-Крафтс).<ref name=":1" /> |
Водороден атом може да се замести и с халогенмагнезилна група като напр. C<sub>2</sub>H<sub>5</sub>MgBr. Продукт на реакцията е циклопентадиенилмагнезиев бромид, който реагира с [[железен дихлорид]] и дава кристалното съединение '''бис-циклопентадиенилжелязо''' (портокалев цвят) наречено [[Фероцен|'''фероцен''']] от [[Роберт Удуърт]]. Фероценът съдържа два петатомни пръстена, изградени от СН-групи. Във всеки от тях четирите π-електрона от π-връзките и двойката електрони от аниона на СН-групата (произлязла, от СН<sub>2</sub>-групата) образуват общ π-секстет. Така фероценът има два π-секстета и притежава ароматен характер (подобно на бензена). Двете ядра са копланарни. Железният атом в това съединение е свързан с петте C-атома на всеки от пръстените подобно на сандвич. „Сандвичевата“ структура на фероцена е потвърдена по рентгенографски път. Фероценът може да реагира с ацетилхлорид, като дава диацетилно производно (синтез по Фридел-Крафтс).<ref name=":1" /> |
||
[[Файл:Bifenyl.svg|link=https://bg.wikipedia.org/wiki/Файл:Bifenyl.svg| |
[[Файл:Bifenyl.svg|link=https://bg.wikipedia.org/wiki/Файл:Bifenyl.svg|мини|160x160px|Структура на '''бифенил''']] |
||
[[Файл:Naphthalin.svg|link=https://bg.wikipedia.org/wiki/Файл:Naphthalin.svg| |
[[Файл:Naphthalin.svg|link=https://bg.wikipedia.org/wiki/Файл:Naphthalin.svg|ляво|мини|139x139px|Структура на '''нафтален''']] |
||
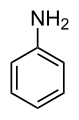
Множество важни химически съединения са производни на бензена, вследствие на заместване на един или повече от водородните му атоми с друга функционална група. Примери за прости бензенови производни са [[фенол]], [[толуен]] и [[анилин]]. Бензеновият остатък (радикал), участващ в различни други съединения, се нарича фенил или фенилова група. Свързването на две бензенови ядра дава [[бифенил]] C<sub>6</sub>H<sub>5</sub>-C<sub>6</sub>H<sub>5</sub>. Последваща загуба на водороден атом води до образуването на полициклични ароматни въглеводороди, като [[нафтален]], [[антрацен]]. Краят на свързването на бензеновите ядра се осъществява при безводородната [[Алотропия|алотропна форма]] на въглерода – [[графит]]. |
Множество важни химически съединения са производни на бензена, вследствие на заместване на един или повече от водородните му атоми с друга функционална група. Примери за прости бензенови производни са [[фенол]], [[толуен]] и [[анилин]]. Бензеновият остатък (радикал), участващ в различни други съединения, се нарича фенил или фенилова група. Свързването на две бензенови ядра дава [[бифенил]] C<sub>6</sub>H<sub>5</sub>-C<sub>6</sub>H<sub>5</sub>. Последваща загуба на водороден атом води до образуването на полициклични ароматни въглеводороди, като [[нафтален]], [[антрацен]]. Краят на свързването на бензеновите ядра се осъществява при безводородната [[Алотропия|алотропна форма]] на въглерода – [[графит]]. |
||
Версия от 19:56, 15 септември 2018

Ароматен въглеводород или арен[1] (понякога арилов въглеводород)[2] е въглеводород с циклична структура и делокализиран π-електронен секстет. Терминът ароматни е предложен преди определянето на физическия механизъм за ароматност и произлиза от факта, че много от тези съединения имат сладникав аромат. Конфигурацията на шестте въглеродни атома в ароматните съединения е известна като пръстен на бензена, по името на възможно най-простия въглеводород, бензена (ост. бензол). Ароматните въглеводороди могат да бъдат моноциклични или полициклични.
В арените въглеродните и водородните атоми образуват бензеново ядро и са свързани помежду си чрез сигма (σ) и 6-пи (π) делокализирана връзка. Въглеродният атом в молекулата на арените се намира в sp2 хибридно състояние.
- Моноядрени арени
Моноядрените арени са изградени от едно бензеново ядро (![]() ). Това са бензенът и неговите хомолози.
). Това са бензенът и неговите хомолози.

- Полиядрени арени
Полиядрени арени има в два случая:
- когато две ядра са свързани помежду си чрез сигма (σ) връзка между два въглеродни атома.
- когато две ядра са свързани помежду си чрез два общи въглеродни атома (бифенил).
Някои небензенови производни съединения, наречени хетероарени, които отговарят на правилото на Хюкел, също са ароматни съединения. В тези съединения най-малко един въглероден атом е заменен с един от хетероатомите кислород, азот или сяра. Пример за небензеново хетеросъединение с ароматни свойства е фуранът, хетероциклено съединения с петчленен пръстен, който включва един кислороден атом, както и пиридин, хетероциклено съединения с шестчленен пръстен, съдържащи един азотен атом.
Бензен и производните му

Бензеновите производни имат между един и шест заместители, свързани към централното ядро. Примери на бензенови производни само с един заместител са фенолът, който носи хидроксилна група, и толуенът с метилова група. Когато има повече от един заместител в пръстена, тяхната пространствена ориентация стават важна, като се делят на орто-, мета-, и пара- ориентирани. Така например, при трите изомера за крезола, метилова и хидроксилна групи може да бъдат поставени в непосредствена близост една от друга (орто), през една позиция (мета) или една срещу друга (пара). Ксиленолът има две метилови групи в допълнение към хидроксилната група и за тази структура съществуват 6 изомера.
- Основни бензенови производни
Ароматност
Правило на Хюкел за ароматност
През 1931 г. Ерих Хюкел извежда т.нар. 4n+2 правило. То гласи, че плоските циклични спрегнати системи са ароматни, ако имат (4n+2) π-електрона (n=1,2,3...), и неароматни, ако имат 4n π-електрона в пръстена. Бензенът има 4n+2=6 π-електрона (n=1) и е ароматен. Циклобутадиенът има 4 π-електрона (n=1) и е антиароматен (крайно неустойчив, получен 1965 г. при -78 °C и веднага се димеризира). Следователно наличието на циклична (затворена) спрегната π-система е необходимо, но не е единствено условие за ароматност.[3] За да бъде едно съединение ароматно, е необходимо да се спази преди всичко и правилото на Хюкел. Правилото обобщено гласи, че в молекулата на съединението трябва:[4]
- да се съдържат атоми, свързани в пръстен (като освен C-атоми в пръстена могат да участват и други атоми – хетероциклични съединения);
- броят на π-електроните от нехибридните p-AO в пръстена да са равни на 4n+2 (Хюкел), като n=0, 1, 2, 3 и т.н.;
- орбиталите на всички атоми в пръстена да са в sp2-хибридизация (виж МВВ).
Просто казано едно циклично съединение е ароматно, ако в пръстена му се редуват двойни и прости връзки и ако съдържа 2, 6, 10, 14, 18 или 26... наброй π-електрони в него:
- 2 (n=0 при циклопропенилиев катион -
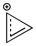 )
) - 6 (n=1 при бензен –
 , пирол
, пирол  и циклопентадиенилнатрий – виж долу)
и циклопентадиенилнатрий – виж долу) - 10 (n=2 при нафтален –
 )
) - 14 (n=3 при антрацен –
 и фенантрен –
и фенантрен – 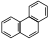 )
) - 18 (n=4 при анулен –
 )
) - 26 (n=6 при хемът на хемоглобина) са с ароматни свойства и са копланарни. Това правило е потвърдено с многобройни синтезирани за целта съединения, но има и такива, които не отговарят на правилото, а имат ароматен характер, напр. пирен.[5]
Ако пръстеновидно съединение има нечетен брой редуващи се двойни връзки, то най-вероятно е ароматно.
Примери за други ароматни съединения
Циклопентадиенилнатрии

От циклопентадиен след изместване водороден атом от метиленовата си група с Натрий се получава циклопентадиенилнатрий, в пръстена на който се съдържат 6 спрегнати π-електрона (4x1+2 = 6), което го прави ароматно съединение. [5]
Фероцен

Водороден атом може да се замести и с халогенмагнезилна група като напр. C2H5MgBr. Продукт на реакцията е циклопентадиенилмагнезиев бромид, който реагира с железен дихлорид и дава кристалното съединение бис-циклопентадиенилжелязо (портокалев цвят) наречено фероцен от Роберт Удуърт. Фероценът съдържа два петатомни пръстена, изградени от СН-групи. Във всеки от тях четирите π-електрона от π-връзките и двойката електрони от аниона на СН-групата (произлязла, от СН2-групата) образуват общ π-секстет. Така фероценът има два π-секстета и притежава ароматен характер (подобно на бензена). Двете ядра са копланарни. Железният атом в това съединение е свързан с петте C-атома на всеки от пръстените подобно на сандвич. „Сандвичевата“ структура на фероцена е потвърдена по рентгенографски път. Фероценът може да реагира с ацетилхлорид, като дава диацетилно производно (синтез по Фридел-Крафтс).[5]


Множество важни химически съединения са производни на бензена, вследствие на заместване на един или повече от водородните му атоми с друга функционална група. Примери за прости бензенови производни са фенол, толуен и анилин. Бензеновият остатък (радикал), участващ в различни други съединения, се нарича фенил или фенилова група. Свързването на две бензенови ядра дава бифенил C6H5-C6H5. Последваща загуба на водороден атом води до образуването на полициклични ароматни въглеводороди, като нафтален, антрацен. Краят на свързването на бензеновите ядра се осъществява при безводородната алотропна форма на въглерода – графит.
Източници
- ↑ Definition IUPAC Gold Book Link
- ↑ Mechanisms of Activation of the Aryl Hydrocarbon Receptor by Maria Backlund, Institute of Environmental Medicine, Karolinska Institutet
- ↑ Марко Кирилов, Георги Нейков и др. – Химия и опазване на околната среда – профилирана подготовка 12. клас – Булвест 2000 – София 2007 – ISBN 978-954-18-0366-0
- ↑ „Органична химия“, Галин Петров, УИ „Св. Климент Охридски“, София, 2006, ISBN-10: 954-07-2382-5
- ↑ а б в М. Николов и др. – Учебник по Химия за студенти по медицина и стоматология – Трето издание – АРСО София 2012 – ISBN: 978-954-8967-26-Х