Бензен
| Бензен | |||||||||
| |||||||||
| Имена | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| По IUPAC | бензен | ||||||||
| Други | бензол (остаряло) | ||||||||
| Свойства | |||||||||
| Формула | C6H6 | ||||||||
| Моларна маса | 78,11 g/mol | ||||||||
| Външен вид | безцветна течност | ||||||||
| Плътност | 0,8765 g/cm3 | ||||||||
| Вискозитет | динамичен: 0,0652 Pl | ||||||||
| Точка на топене | 5,5 °C, 278,7 K | ||||||||
| Точка на кипене | 80,1 °C, 353,3 K | ||||||||
| Парно налягане | 10 000 Pa (20 °C) | ||||||||
| Разтворимост във вода | 1,8 g/L (15 °C) | ||||||||
| λ Max | 255 nm | ||||||||
| Магнитна възприемчивост | 54,8x10-6 cm3/mol | ||||||||
| Показател на пречупване | 1,4979 | ||||||||
| Диполен момент | 0 D | ||||||||
| Термохимия | |||||||||
| Стандартна енталпия на образуване | 82 930 J/mol (газ) | ||||||||
| Стандартна моларна ентропия | 172,8 J/(mol·K) (течност)[1] | ||||||||
| Специфичен топлинен капацитет | 16,157 (течност; 25 °C) | ||||||||
| Опасности | |||||||||
| ЕС класификация | Канцероген кат. 1 Мутаген кат. 2 | ||||||||
| H-фрази | H225, H304, H315, H319, H340, H350, H372 | ||||||||
| P-фрази | P201, P210, P280, P308+P313, P370+P378, P403+P235[2] | ||||||||
| Фрази за риск | R45, R46, R11, R36/38, R48/23/24/25, R65 | ||||||||
| Фрази за безопасност | S53, S45 | ||||||||
| NFPA 704 |
| ||||||||
| Точка на запалване | -11,63 °C, 262 K | ||||||||
| Точка на самозапалване | 498 °C, 771 K | ||||||||
| LD50 | 88 mg/kg (заек подземник) | ||||||||
| Инхалация | объркване, тахикардия | ||||||||
| Контакт с очите | увреждане | ||||||||
| Сродни съединения | |||||||||
| Други | толуен, боразин | ||||||||
| Идентификатори | |||||||||
| CAS номер | 71-43-2 | ||||||||
| PubChem | 241 | ||||||||
| ChemSpider | 236 | ||||||||
| Номер на ЕК | 200-753-7 | ||||||||
| Номер на ООН | 1114 | ||||||||
| KEGG | C01407 | ||||||||
| MeSH | D001554 | ||||||||
| ChEBI | 16716 | ||||||||
| ChEMBL | CHEMBL277500 | ||||||||
| RTECS | CY1400000 | ||||||||
| SMILES | c1ccccc1 | ||||||||
| InChI | InChI=1S/C6H6/c1-2-4-6-5-3-1/h1-6H | ||||||||
| InChI ключ | UHOVQNZJYSORNB-UHFFFAOYSA-N | ||||||||
| UNII | J64922108F | ||||||||
| Gmelin | 1671 | ||||||||
| Данните са при стандартно състояние на материалите (25 °C, 100 kPa), освен ако не е указано друго. | |||||||||
| Бензен в Общомедия | |||||||||
Бензенът (ост. бензол, C6H6) е най-простият бензоиден ароматен въглеводород, широко използван органичен разтворител, образуващ азеотропна смес с вода. Представлява безцветна, лесно възпламенима течност със сладникав аромат. Той е отровен и канцерогенен. Влиза в състава на бензина и нефта. Mоже да бъде синтезиран чрез тримеризация на ацетилен при нагряване над активен въглен. Основната му употреба е за производството на етилбензен и кумен, чиито годишни добиви достигат милиони тонове.
История[редактиране | редактиране на кода]
Откриване[редактиране | редактиране на кода]
Бензенът за първи път е отделен през 1825 г. от Майкъл Фарадей чрез нагряване на китова мас. Тогава Фарадей го нарича „водороден бикарбурет“. През 1845 г. Чарлз Менсфийлд отделя бензен от каменовъглена смола, а четири години по-късно патентова промишлен начин за синтез на бензена.
Циклична формула[редактиране | редактиране на кода]

Фарадей открива и емпиричната формула на бензена, C6H6. Според тогавашните разбирания резултатът е парадоксален, защото противоречи на представата, че в своите съединения въглеродът образува четири единични връзки, а водородът – една. В търсене на правилната структура на бензена, която да обясни необичайната стабилност и химична инертност, много учени, сред които Джеймс Дюар, Адолф Карл Лудвиг Клаус и Алберт Ладенбург, предлагат неправилни структури.
Първият учен, предположил, че бензенът има пръстеновидна структура, е немският химик Фридрих Август Кекуле (1865 г.). Известен анекдот гласи, че една вечер, когато Кекуле мислел върху загадъчната структура на бензена, той заспал и му се присънил уроборос – змия, която е захапала опашката си. Именно този символ, според легендата, навел химика на извода, че бензенът има пръстеновидна структура с алтерниращи 3 двойни връзки.
Цикличната природа на бензена окончателно е потвърдена от кристалографа Катлийн Лонсдейл през 1929 г.[3][4]
Електронна структура[редактиране | редактиране на кода]


Особеностите в структурата на бензена се обясняват от съвременните квантово-механични представи за електронната конфигурация на атомите.[5]
Атомните орбитали на всеки въглероден атом от бензеновото ядрое в sp2-хибридизация. Така тези атоми имат има три хибридни sp2-АО и една нехибридна p-АО. Трите хибридни sp2 орбитали лежат на една равнина и имат правилна плоскотриъгълна конфигуриция. Шестте въглеродни атома образуват плосък пръстен. Всичките шест нехибридни p-АО са разположени перпендикулярно на равнината на шестатомния пръстен. Те частично се припокриват и формират кръгова делокализирана 6π-връзка.[5] Три от тях са с по-ниска енергия от тази на изходните 2р-атомни орбитали и са свързващи молекулни орбитали. Останалите три са с по-висока енергия от тази на изходните 2р-атомни орбитали и са антисвързващи.
Данните от рентгеноструктурния анализ потвърждават тези представи за структурата на бензена. Установена е еднаква дължина на всички C-C връзки 0,139 nm и C-H връзки 0,109 nm в молекулата. Дължината на C-C връзките по стойност заема междинно положение в сравнение с дължините на една σ-C-C връзка (0,154 nm) и C=C връзка (0,134 nm). Порядъкът на всички C-C връзки в бензена е еднакъв – 1,67.[5]
Физични свойства[редактиране | редактиране на кода]
Бензенът е безцветна течност с миризма, подобна на бензиновата. Топи се при 5,5 °С, а кипи на 80,1 °С. Относително високите температури на топене и кипене на бензена в сравнение с тази на хексана (68,8 °С), който има по-голяма молекулна маса, се обяснява с плоската му и стабилна структура, при която Вандерваалсовите сили между молекулите са по-здрави. Бензенът има голям коефициент на пречупване. Разтваря се слабо във вода и добре в много органични разтворители. Бензенът е добър разтворител на органични съединения.[6]
Химични свойства[редактиране | редактиране на кода]
В молекулата на бензена има стабилна ароматна 6π-връзка. Химичните му свойства се определят от полученото стабилно бензеново ядро в молекулата, което се стреми да запази структурата си. Затова за бензена са характерни предимно заместителни реакции, които са критерии за ароматния характер, а не толкова присъединителни реакции.
Електрофилни заместителни реакции[редактиране | редактиране на кода]
Реакциите протичат по общ SE2-механизъм. Електрофилните заместители могат да бъдат катиони – NO2+, полярни молекули – SO3, или неполярни молекули като Cl2 и Br2, които се поляризират под действие на катализатор.
Халогенирането на бензен протича с катализатор Люисови киселини – AlCl3, FeCl3, FeBr3, ZnCl2 и др.

Нитрирането на бензен се извършва при слабо нагряване с нитрирна смес – смес от концентрирана HNO3 и H2SO4 в отношение 1:2, в която се образува нитрониевият йон:
.

Образува се жълта маслообразна течност с мирис на горчиви бадеми – нитробензен.
Сулфонирането на бензен се осъществява се с концентрирана H2SO4при нагряване:

Алкилирането на бензен е метод за получаване на негови производни. Реакцията протича с халогеноалкан или алкен и катализатор Люисова киселина.

При ацилирането на бензен с киселинни хлориди в присъствие на катализатор Люисови киселини се получават мастно-ароматни кетони. При взаимодействието на етаноилхлорид и бензен се получава метилфенилкетон (ацетофенон):

Присъединителни реакции[редактиране | редактиране на кода]
Протичат трудно поради стабилността на делокализираната 6π-връзка на ароматното ядро, която трудно се разкъсва. Реакциите протичат при по-груби условия. Бензенът не присъединява халогеноводороди, вода и други полярни съединения, за разлика от алкените и алкините.
В присъствие на активни катализатори – Ni или Pd/C, при висока температура и налягане, е възможно пълно хидриране:
.
При взаимодействие на бензен с хлор или бром и облъчване с UV лъчи протича заместителна реакция по верижно-радикалов механизъм:
Възможно е фотохимично или термохимично циклоприсъединяване, подобно на реакции на Дилс–Алдер.
Бензенови радикали могат да се получат при взаимодействие с активни метали, които са донори на електрони:
.
Окисление[редактиране | редактиране на кода]
Бензеновото ядро е много устойчиво спрямо окислители, но може да се окисли с кислород от въздуха при нагряване и катализатор V2O5 до фенол. Бензенът и хомолозите му горят с пушлив пламък.
Производни[редактиране | редактиране на кода]
При заместване на един или повече от водородните атоми в бензеновото ядро с друга функционална група се получават множество производни – фенол, толуен и анилин, бифенил, нафтален, антрацен. Краят на свързването на бензеновите ядра се осъществява при безводородната алотропна форма на въглерода – графит.
- Основни класове бензенови производни
-
[Os(NH3)5(η2-C6H6)]2+
-
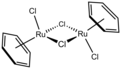
((C6H6)RuCl2)2
-
(C6H3(CH3)3Au)6
-
M(η6-C6H6)(CO)3
-
(CpRh)3(η2-C6H6)
Получаване[редактиране | редактиране на кода]
Дестилация на каменовъглено масло[редактиране | редактиране на кода]
Бензенът се получава чрез дестилация на лекото каменовъглено масло, но така получен е замърсен с около 0,5% тиофен, който има близка температура на кипене и се отделя чрез разклащане с концентрирана сярна киселина.[6]
От калциев бензоат[редактиране | редактиране на кода]
Бензен се получава чрез нагряване на калциев бензоат с калциев хидроксид или натриев бензоат с натриева основа. Тази реакция е подобна на реакцията на Дюма за получаване на мастни въглеводороди:[6]
От фенол[редактиране | редактиране на кода]
Друг метод е чрез дестилация на фенол с цинков прах:[6]
Метод на Бертло (риформинг)[редактиране | редактиране на кода]
Тримеризация на етин (ацетилен) при прекарването му през нажежена тръба, при което той се полимеризира (Метод на Бертло)[6]. Процесът се нарича риформинг. Протича в присъствие на платинови катализатори:
Дехидроциклизация и ароматизация на нефт[редактиране | редактиране на кода]
Употреба[редактиране | редактиране на кода]

Бензенът се използва главно като суровина за производството на други химикали. Около 80% от него се използва за получаването на етилбензен, кумен и циклохексан. От тях най-масова употреба намира етилбензенът, прекурсор за синтеза на стирен, който от своя страна влиза в състава на полимери и различни видове пластмаси. Куменът е източник за получаването на фенол, необходим за направата на смоли и лепила. Циклохексан е суровина за синтеза на найлони. Малки количества от самия бензен се използват за получаване на някои видове синтетичен каучук, смазки, бои, детергенти, лекарства, експлозиви и пестициди.
В лабораторните изследвания толуенът напълно е заменил бензена като органичен разтворител, най-вече поради по-ниската си токсичност, като свойствата им на разтворители са много сходни.
В бензина се включва като добавка, повишаваща октановото число и стабилизираща горивния процес.
Токсичност[редактиране | редактиране на кода]
Професионално заболяване от вдишване на бензенови пари, понякога от контакт с кожата е бензеновото отравяне. При тежки случаи се наблюдават смущения на централната нервна система, гърчове, повръщане, безсъние и др. При по-лекото бензеново отравяне – увреждане на кръвотворните органи с промени в количеството и състава на белите кръвни клетки, кръвоизливи в кожата и лигавицата (хеморагична диатеза) и др. При продължително излагане на влиянието на бензена се развиват различни форми на рак.
Вижте също[редактиране | редактиране на кода]
Източници[редактиране | редактиране на кода]
- ↑ chem.libretexts.org // Посетен на 25 януари 2019 г.
- ↑ Benzene // Посетен на 11 юни 2018 г. (на английски)
- ↑ K. Lonsdale. The Structure of the Benzene Ring in Hexamethylbenzene // Proceedings of the Royal Society 123A. 1929. с. 494.
- ↑ K. Lonsdale. An X-Ray Analysis of the Structure of Hexachlorobenzene, Using the Fourier Method // Proceedings of the Royal Society 133A. 1931. с. 536 – 553.
- ↑ а б в Петров, Галин. Органична химия. София, Университетско издателство „Св. Климент Охридски“, 2006. ISBN 978-954-07-2382-2. с. 230 – 274.
- ↑ а б в г д Николов, М. Учебник по Химия за студенти по медицина и стоматология. София, АРСО, 2012. ISBN 978-954-8967-26-Х.
Литература[редактиране | редактиране на кода]
- Vollhard, K. Peter C.; Schore, Neil C. – Organic Chemistry: structure and function, 4th edition, 2002
- Ганка Робова, Лилия Величкова. „Теми по органична химия за ученици и кандидат-студенти“, изд. Абагар
| Тази страница частично или изцяло представлява превод на страницата „Benzene“ и страницата „Бензол“ в Уикипедия на английски и руски език. Оригиналните текстове, както и този превод, са защитени от Лиценза „Криейтив Комънс – Признание – Споделяне на споделеното“, а за творби създадени преди юни 2009 година – от Лиценза за свободна документация на ГНУ. Прегледайте историята на редакциите на оригиналните страници тук и тук, за да видите списъка на техните съавтори.
ВАЖНО: Този шаблон се отнася единствено до авторските права върху съдържанието на статията. Добавянето му не отменя изискването да се посочват конкретни източници на твърденията, които да бъдат благонадеждни. |









![{\displaystyle {\ce {K* + C6H6 -> K+[C6H5]^- + H+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2b0f522270160b4f35ea28e3cc1985eb87433ed0)










![[Os(NH3)5(η2-C6H6)]2+](http://upload.wikimedia.org/wikipedia/commons/thumb/5/5f/OsA5%28eta-2-benzene%29.png/120px-OsA5%28eta-2-benzene%29.png)