Хлорофил
Хлорофил (от гръцки: χλωρός – „зелен“ и φύλλον – „лист“) е зелен пигмент, открит в голяма част от растенията, някои водорасли и зелени гъби. Съдържа се в хлоропластите при висшите и в хроматофорите при низшите растения. При негово участие се извършва фотосинтезата. Количеството му в листата е от 0,6 до 1,2%. Поглъща слънчева енергия и я трансформира в енергия на химичните връзки в органичните съединения, които се синтезират в процеса на фотосинтезата. По химически състав хлорофилът е от групата на органичните съединения. Има сложен химичен състав – представлява белтък, свързан с магнезий.
Хлорофилът не се разтваря във вода. Свързва се нековалентно с белтъци в пигмент-белтъчни комплекси. Извлича се с помощта на органични разтворители – алкохол, ацетон, бензол, хлороформ.
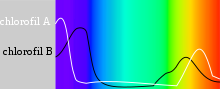
Хлорофилът поглъща слънчевата енергия най-силно в синята и червената части на видимия спектър.[2] Обратно, в зеления участък на спектъра поглъщането е намалено, а дифузното отражение от стените на клетките е повишено. Затова тъканите, богати на хлорофил, се възприемат от човешкото око като оцветени в зелено.[1] При зелените растения съществуват два типа хлорофил: хлорофил a и хлорофил b.[3]
История[редактиране | редактиране на кода]
Хлорофилът е изолиран и наименуван за пръв път от французите Жозеф Биенеме Кавенту и Пиер Жозеф Пелетие през 1817 г.[4] Присъствието на магнезий в хлорофила е открито през 1906 г.,[5] което е и първият път, когато магнезий е засечен в жива тъкан.[6]
След първоначална работа, направена от германския химик Рихард Вилщетер в периода от 1905 до 1915 г., общата структура на хлорофил a е изяснена от Ханс Фишер през 1940 г. Към 1960 г., когато по-голямата част от стерохимията на хлорофила a е опозната, Робърт Бърнс Удуърд публикува цял синтез на молекулата.[6][7] През 1967 г. последните останали стереохимични изяснения са завършени от английския химик Иън Флеминг,[8] а през 1990 г. Удуард и екип публикуван обновен синтез.[9] През 2010 г. е обявено, че хлорофил f присъства в цианобактерии и други аеробни микроорганизми, които образуват строматолити.[10][11] Дедуцирани са молекулната формула C55H70O6N4Mg и структурата (2-формил)-хлорофил a.[12]
Фотосинтеза[редактиране | редактиране на кода]
Хлорофилът е жизненоважен за фотосинтезата, която позволява на растенията да приемат енергия от светлината.[13]
Хлорофилните молекули се подреждат във и около фотосистеми, които са вградени в тилакоидните мембрани на хлоропластите.[14] В тези комплекси хлорофилът служи за три функции. Функцията на по-голямата част от хлорофила (до няколкостотин молекули на фотосистема) е да абсорбира светлина. Правейки това, същите центрове извършват втора функция – да преобразуват светлинната енергия чрез резонантен енергиен трансфер към определена хлорофилна двойка в реакционния център на фотосистемите. Тази двойка влияе върху крайната функция на хлорофила – разделяне на зарядите, водейки до биосинтеза. Идентичността, функцията и спектралните свойства на видовете хлорофил във всяка фотосистема са различни, както е различна и протеиновата структура около тях. Веднъж извлечени от протеина в разтворител (като например ацетон или метанол), тези хлорофилни пигменти могат да се разделят на хлорофил a и хлорофил b.[15][16][17]
Функцията на реакционния център на хлорофила е да абсорбира светлинна енергия и да я прехвърли към други части на фотосистемата. Приетата енергия на фотона се преобразува на електрон в процес, наречен разделяне на заряда. Премахването на електрон от хлорофила е оксидираща реакция. Хлорофилът дава високоенергийния електрон на ред молекулни посредници, което се нарича електрон-транспортна верига. Зареденият реакционен център на хлорофила (P680+) тогава се редуцира към базовото си ниво като приема електрон от вода. Електронът, който редуцира P680+, накрая идва от оксидацията на вода в O2 и H+ чрез няколко посредници. Тази реакция обяснява как фотосинтезиращи организми като растенията произвеждат O2 и са източник на практически всичкия кислород в земната атмосфера.
Потокът от електрони, произведен от реакционния център, се използва за изпомпване на H+ йони през тилакоидната мембрана, установявайки хемиосмотичен потенциал, използван основно при произвеждането на АТФ (съхраняване на химична енергия) или за да редуцира НАДФ+ до НАДФ. НАДФ е универсален агент, използван за редуцирането на CO2 до захари.
Хлорофил-протеиновите комплекси на реакционните центрове са способни директно да абсорбират светлина и да изпълняват разделяне на заряди без помощта на други хлорофилни пигменти, но вероятността това да се случи при даден интензитет на светлината е малка. Следователно с другите хлорофили във фотосистемата всички кооперативно абсорбират и насочват светлинна енергия към реакционния център. Освен хлорофил a, съществуват и други спомагателни пигменти.
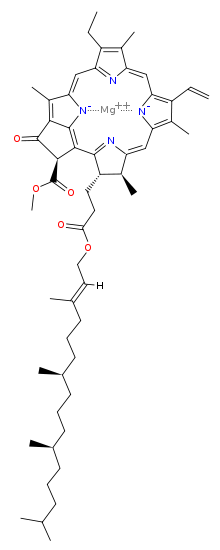
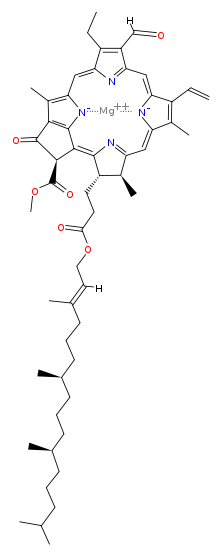
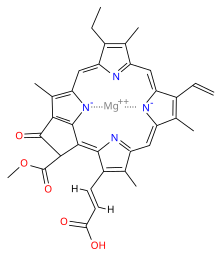
Химична структура[редактиране | редактиране на кода]
| Хлорофил a | Хлорофил b | Хлорофил c1 | Хлорофил c2 | Хлорофил d | |
|---|---|---|---|---|---|
| Молекулна формула | C55H72O5N4Mg | C55H70O6N4Mg | C35H30O5N4Mg | C35H28O5N4Mg | C54H70O6N4Mg |
| C3 група | -CH=CH2 | -CH=CH2 | -CH=CH2 | -CH=CH2 | -CHO |
| C7 група | -CH3 | -CHO | -CH3 | -CH3 | -CH3 |
| C8 група | -CH2CH3 | -CH2CH3 | -CH2CH3 | -CH=CH2 | -CH2CH3 |
| C17 група | -CH2CH2COO-Phytyl | -CH2CH2COO-Phytyl | -CH=CHCOOH | -CH=CHCOOH | -CH2CH2COO-Phytyl |
| C17-C18 връзка | единична | единична | двойна | двойна | единична |
| Разпространение | навсякъде | повечето растения | някои гъби | някои гъби | цианобактерии |
 |
 |
 |
 |
 |
Кулинарна употреба[редактиране | редактиране на кода]
Хлорофилът е регистриран като хранителна добавка (оцветител) и Е-номер е Е140. Готвачите използват хлорофил, за да оцветяват различни храни или напитки в зелено, като например паста и абсент.[18] Хлорофилът е неразтворим във вода и затова първо се смесва с малко количество растителна мазнина, за да се получи желания разтвор.
Източници[редактиране | редактиране на кода]
- ↑ а б Chlorophyll does not reflect green light – how to correct a misconception // Journal of Biological Education 56 (5). 2020. DOI:10.1080/00219266.2020.1858930. с. 1 – 8.
- ↑ Influence of green, red and blue light emitting diodes on multiprotein complex proteins and photosynthetic activity under different light intensities in lettuce leaves (Lactuca sativa L.) // International Journal of Molecular Sciences 15 (3). March 2014. DOI:10.3390/ijms15034657. с. 4657 – 70.
- ↑ Photosynthetic Pigments // UCMP Glossary (online). University of California Museum of Paleontology, 1997. Посетен на 2010-07-17.
- ↑ Delépine, Marcel. Joseph Pelletier and Joseph Caventou // Journal of Chemical Education 28 (9). септември 1951. DOI:10.1021/ed028p454. с. 454. * Pelletier and Caventou (1817) "Notice sur la matière verte des feuilles", Journal de Pharmacie, 3: 486 – 491. с. 490: „Nous n'avons aucun droit pour nommer une substance connue depuis long-temps, et à l'histoire de laquelle nous n'avons ajouté que quelques faits; cependant nous proposerons, sans y mettre aucune importance, le nom de chlorophyle, de chloros, couleur, et φυλλον, feuille: ce nom indiquerait le rôle qu'elle joue dans la nature.“
- ↑ Willstätter, Richard (1906) "Zur Kenntniss der Zusammensetzung des Chlorophylls", Annalen der Chemie, 350: 48 – 82. с. 49: „Das Hauptproduct der alkalischen Hydrolyse bilden tiefgrüne Alkalisalze. In ihnen liegen complexe Magnesiumverbindungen vor, die das Metall in einer gegen Alkali auch bei hoher Temperatur merkwürdig widerstandsfähigen Bindung enthalten.“
- ↑ а б Motilva, Maria-José. Chlorophylls – from functionality in food to health relevance // 5th Pigments in Food congress – for quality and health. University of Helsinki, 2008. ISBN 978-952-10-4846-3.
- ↑ Woodward, R. B. и др. The total synthesis of chlorophyll // Journal of the American Chemical Society 82 (14). юли 1960. DOI:10.1021/ja01499a093. с. 3800 – 3802.
- ↑ Fleming, Ian. Absolute Configuration and the Structure of Chlorophyll // Nature 216 (5111). 14 октомври 1967. DOI:10.1038/216151a0. с. 151 – 152.
- ↑ Woodward, R. B. и др. The total synthesis of chlorophyll a (PDF) // Tetrahedron 46 (22). 1990. DOI:10.1016/0040-4020(90)80003-Z. с. 7599 – 7659.
- ↑ Jabr, Ferris (19 август 2010) A New Form of Chlorophyll?. Scientific American.
- ↑ Infrared chlorophyll could boost solar cells. New Scientist. 19 август 2010.
- ↑ Chen, Min и др. A Red-Shifted Chlorophyll // Science 329 (5997). September 2010. DOI:10.1126/science.1191127. с. 1318 – 1319.
- ↑ Carter, J. Stein. Photosynthesis // University of Cincinnati, 1996. Архивиран от оригинала на 2013-06-29. Посетен на 2018-04-03.
- ↑ Nature. Unit 1.3. Photosynthetic Cells // Essentials of Cell Biology. nature.com, 5 юли 2013.
- ↑ Marker, A. F. H. The use of acetone and methanol in the estimation of chlorophyll in the presence of phaeophytin // Freshwater Biology 2 (4). 1972. DOI:10.1111/j.1365-2427.1972.tb00377.x. с. 361 – 385.
- ↑ Jeffrey, S. W. Some Spectral Characteristics of Chlorophyll c from Tridacna crocea Zooxanthellae // Biological Bulletin 136 (1). Marine Biological Laboratory, февруари 1969. DOI:10.2307/1539668. с. 54 – 62.
- ↑ Gilpin, Linda. Methods for analysis of benthic photosynthetic pigment // School of Life Sciences, Napier University, 21 март 2001. Архивиран от оригинала на 2008-04-14. Посетен на 2018-04-03.
- ↑ Adams, Jad. Hideous absinthe: a history of the devil in a bottle. United Kingdom, I.B.Tauris, 2004, 2004. ISBN 1860649203. с. 22.
| Тази страница частично или изцяло представлява превод на страницата Chlorophyll в Уикипедия на английски. Оригиналният текст, както и този превод, са защитени от Лиценза „Криейтив Комънс – Признание – Споделяне на споделеното“, а за съдържание, създадено преди юни 2009 година – от Лиценза за свободна документация на ГНУ. Прегледайте историята на редакциите на оригиналната страница, както и на преводната страница, за да видите списъка на съавторите.
ВАЖНО: Този шаблон се отнася единствено до авторските права върху съдържанието на статията. Добавянето му не отменя изискването да се посочват конкретни източници на твърденията, които да бъдат благонадеждни. |


