Пирол
| Пирол | |
|---|---|

| |
| Обща информация | |
| Наименование по IUPAC | 1H-пирол /Чисто: 1-азациклопента-2,4-диен/ |
| Други имена | Азол |
| Молекулна формула | C4H5N |
| Моларна маса | 67,09 g/mol |
| Външен вид | безцветна течност |
| CAS номер | [109-97-7] |
| Свойства | |
| Плътност и фаза | 0,9698 g/cm3, течност |
| Разтворимост във вода | 45 g/l (25 °C) |
| Други разтворители | етанол, етер и разредени киселини |
| Точка на топене | -23,4 °C (249,75 K) |
| Точка на кипене | 129,7 °C (402,85 K) |
| Киселинност (pKa) | pKa1=0,4 (PyrH+/PyrH) pKa2=16,5 (PyrH/Pyr-) |
| Структура | |
| Диполен момент | 1,767 D |
| Точка на възпламеняване | 39 °C |
| Освен където е обявено друго, данните са дадени за материали в стандартно състояние (при 25 °C, 100 kPa) Права и справки | |
Пирол е хетероциклично ароматно органично съединение, петатомен пръстен с молекулна формула C4H5N[1]. Заместените производни се наричат също пироли, например C4H4NCH3 се нарича N-метилпирол. Порфобилиноген е тризаместен пирол, представляващ биосинтетичен прекурсор на множество природни продукти.[2] За сравнение, шестатомни пръстени съдържащи един азотен атом се наричат пиридини.
Пиролите са компоненти на по-сложни макроцикли: порфиринът съдържащ се в хема, хлорини, бактериохлорини, хлорофил и пофириногени.[3]
Свойства
[редактиране | редактиране на кода]Пиролът има много ниска базичност в сравнение с обикновените амини и някои други ароматни съединения като пиридина. Тази понижена базичност се дължи на делокализацията на свободната електронна двойка при азотния атом в ароматния пръстен. Пиролът е много слаба основа с pKaH от около -4. Протонирането води до загуба на ароматност, следователно не е предпочитано. Подобно на много амини пиролът потъмнява изложен на въздух и светлина, поради което трябва да бъде дестилиран непосредствено преди употреба.[4]
-
Дестилация на пирол.
-
Дестилиран пирол. Безцветен след пречистването от примеси, пример за такъв е полипиролът.
Получаване
[редактиране | редактиране на кода]Пиролът се произвежда промишлено при обработката на фуран с амоняк при присъствие на катализатори твърди киселини.[5]
Друг метод за синтез на пирол включва декарбоксилирането на амониев лигат, амониевата сол на лигавата киселина. Солта се нагрява разтворена в глицерол.[6]
Заместени пироли
[редактиране | редактиране на кода]Съществуват много методи за органичен синтез на пиролови производни. Класическите „именни реакции“ са пиролов синтез на Кнор, пиролов синтез на Ханч и синтез на Паал-Кнор. По-специализирани методи са дадени по-долу:
Пиролов синтез на Пилоти-Робинсън представлява взаимодействието на алдехид и хидразин.[7][8] Продукът е пирол със специфични заместители на 3-та и 4-та позиции. Алдехидът взаимодейства с диамина до междинно съединение диимин (R–C=N−N=C–R), което при прибавяне на солна киселина дава затваряне на пръстена и отцепване на молекула амоняк до образуване на пирол.
При една такава модификация на тази реакция, пропионов алдехид се обработва първо с хидразин, а след това и с бензоилхлорид при висока температура и с помощта на микровълни:[9]
При втората стъпка протича [3,3]сигматропна прегрупировка
Пиролът може да се полимеризира до полипирол.
Реакционна способност
[редактиране | редактиране на кода]Водородният атом при азота е умерено киселинен с pKa 16,5. Пиролът може да се депротонира със силни основи като бутиллитий и натриев хидрид. Полученият алкален пиролид е нуклеофилен. Обработката на тази спрегната база с електрофил, например метил йодид(йодометан), дава N-метилпирол.
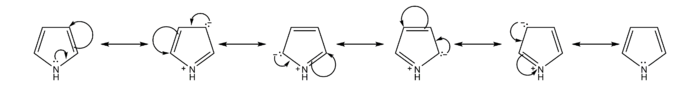
Резонансните структури на пирола предоставят вникване в реакционната способност на съединението. Подобно на фурана и тиофена, пиролът е по-реативоспособен в сравнение с бензена, по отношение на нуклеофилното ароматно заместване, тъй като е способен да стабилизира отрицателния заряд на междинния карбанион.
Пиролът встъпва в реакции на електрофилно ароматно заместване основно на 2-ра и 5-а позиции. Две такива реакции, които са особено важни за получаването на функционални пироли са реакцията на Маних и реакцията на Вилсмайер-Хаак [10][11] като всяка от двете е съвместима с множество пиролови субстрати.
Пиролите взаимодействат с алдехиди до образуване на порфирини. Например бензалдехид се кондензира с пирол, получавайки се тетрафенилпорфирин. Пироловите съединения могат също да участват в реакции на циклоприсъединяване (реакция на Дийлс-Алдер) при определни условия, като присъствие на катализатор Люйсова киселина, нагряване и/или високо налягане.
Пиролът полимеризира на светлина. Също, окисляващ агент като амониев персулфат, може да се използва, обикновено при 00C и тъмнина, за контрол на полимеризацията.
Употреба
[редактиране | редактиране на кода]Пиролът няма съществено търговско приложение, но N-метилпиролът е прекурсор на N-метилпиролкарбоксилната киселина, използвана на широко във фармацевтичната химия.[5]
Аналози и производни
[редактиране | редактиране на кода]Структурни аналози на пирола са:
- Пиролин, частично наситен аналог с една двойна връзка
- Пиролидин, напълно наситеният (хидрогениран) аналог
Хетероатомни структурни аналози на пирола са:
- Фуран, кислороден аналог
- Тиофен, серен аналог
- Арсол, арсенов аналог
- Бисмол, бисмутов аналог
- Борол, борен аналог
- Галол, галиев аналог
- Гермол, германиев аналог
- Фосфол, фосфорен аналог
- Силол, силициев аналог
- Станол, калаен аналог
- Стилбол, антимонов аналог
Към производните на пирола спада и индола, който представлява пирол с кондензирано бензеново ядро.
Източници
[редактиране | редактиране на кода]- ↑ Loudon, Marc G. Chemistry of Naphthalene and the Aromatic Heterocycles. // Organic Chemistry. Fourth. New York, Oxford University Press, 2002. ISBN 0-19-511999-1. с. 1135–1136.
- ↑ Cox, Michael; Lehninger, Albert L; Nelson, David R. Lehninger principles of biochemistry. New York, Worth Publishers, 2000. ISBN 1-57259-153-6.
- ↑ Jonas Jusélius and Dage Sundholm. The aromatic pathways of porphins, chlorins and bacteriochlorins // Phys. Chem. Chem. Phys. 2. 2000. DOI:10.1039/b000260g. с. 2145–2151.
- ↑ Armarego, Wilfred, L.F.; Chai, Christina, L.L. Purification of Laboratory Chemicals. 5th. Elsevier, 2003. с. 346.
- ↑ а б Albrecht Ludwig Harreus "Pyrrole" in Ullmann's Encyclopedia of Industrial Chemistry, 2002, Wiley-VCH, Weinheim.
- ↑ Practical Organic Chemistry, Vogel, 1956, Page 837, Link (12 MB)
- ↑ Piloty, O. Synthese von Pyrrolderivaten: Pyrrole aus Succinylobernsteinsäureester, Pyrrole aus Azinen // Chem. Ber. 43. 1910. DOI:10.1002/cber.19100430182. с. 489.
- ↑ Robinson, Gertrude Maud и др. LIV.—A new synthesis of tetraphenylpyrrole // J. Chem. Soc. 113. 1918. DOI:10.1039/CT9181300639. с. 639.
- ↑ Benjamin C. Milgram, Katrine Eskildsen, Steven M. Richter, W. Robert Scheidt, and Karl A. Scheidt. Microwave-Assisted Piloty-Robinson Synthesis of 3,4-Disubstituted Pyrroles (Note) // J. Org. Chem. 72 (10). 2007. DOI:10.1021/jo070389. с. 3941–3944.
- ↑ Jose R. Garabatos-Perera, Benjamin H. Rotstein, and Alison Thompson. Comparison of Benzene, Nitrobenzene, and Dinitrobenzene 2-Arylsulfenylpyrroles // J. Org. Chem. 72 (19). 2007. DOI:10.1021/jo070493r. с. 7382–7385.
- ↑ The 2-sulfenyl group in the pyrrole substrate serves as an activating group and as a protective group that can be removed with Raney nickel
Външни препратки
[редактиране | редактиране на кода]- ((en)) Синтез и реактивност на пирола
- ((en)) Синтез на пироли (преглед на съвременните методи)
- ((en)) Механизми на заместителните реакции при азотсъдържащи хетероатомни системи Архив на оригинала от 2006-09-08 в Wayback Machine.
| Тази страница частично или изцяло представлява превод на страницата Pyrrole в Уикипедия на английски. Оригиналният текст, както и този превод, са защитени от Лиценза „Криейтив Комънс – Признание – Споделяне на споделеното“, а за съдържание, създадено преди юни 2009 година – от Лиценза за свободна документация на ГНУ. Прегледайте историята на редакциите на оригиналната страница, както и на преводната страница, за да видите списъка на съавторите.
ВАЖНО: Този шаблон се отнася единствено до авторските права върху съдържанието на статията. Добавянето му не отменя изискването да се посочват конкретни източници на твърденията, които да бъдат благонадеждни. |





