Електролиза
За информацията в тази статия или раздел не са посочени източници. Въпросната информация може да е непълна, неточна или изцяло невярна. Имайте предвид, че това може да стане причина за изтриването на цялата статия или раздел. |
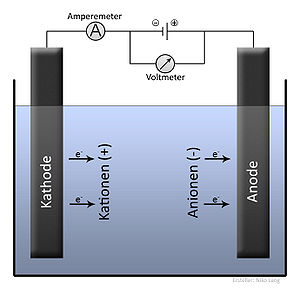
Електролиза е физикохимичен процес, при който при преминаване на електрически ток през разтвор се получава отделяне върху електродите на съставните части на разтвореното вещество или на други вещества, получени при вторични реакции. Положителният електрод е анод, а отрицателният катод, положителните йони – катиони, а отрицателните – аниони.
При прилагане на напрежение на единия от електродите се установява излишък от електрони (отрицателно зареден електрод, катод) а на другия недостиг на електрони (положително зареден електрод, анод). Отрицателно заредения електрод привлича положително заредените йони (катиони) в разтвора, които се придвижват към него. Достигнали катода (-), йоните могат да приемат електрон(и) и да се редуцират:
По аналогия анионите се привличат от анода (+), там те отдават електрони и се окисляват:
Горните процеси на редукция/окисление могат да се извършат само ако се превиши определена стойност на електродния потенциал. (За първата реакция U ≤ 0 V, за втората U ≥ +1,23 V). За да протекат двата процеса на електродите трябва да се приложи минимално напрежение U = 1,23 – (0) = 1,23 V.
Електроден потенциал
[редактиране | редактиране на кода]Абсолютната стойност на електродния потенциал не може да се измери, но измерването на напрежение (разликата между потенциалите на два електрода) е възможно. Затова потенциалът на стандартния водороден електрод (вж. горе) се дефинира като нула волта, а стандартният електроден потенциал на другите електроди се дефинира като напрежението, измерено между стандартния водороден електрод и съответния електрод.
Стойностите на електродния потенциал за много полуреакции могат да се намерят в таблица на електродните потенциали ((en)).
В тази таблица окислената форма на компонента е отляво, а редуцираната – отдясно на стрелката. Разликата в потенциалите (по-положителния минус по-отрицателния) дава минималното напрежение, което трябва да се приложи, за да протекат двата процеса.
При наличието на няколко възможни реакции (напр. няколко различни вида катиони в разтвора) на катода протича първо процесът с по-висок (по-положителен) електроден потенциал. По тази причина не е възможно отделянето по електролитен път на алуминий от водни разтвори на алуминиеви соли. В този случай на катода се получава винаги водород. По тази логика не би трябвало да е възможно и отделянето на цинк, желязо и др. от водни разтвори. На практика обаче електролитното поцинковане е възможно. Това се дължи на т. нар. свръхнапрежение. Поради различни кинетични процеси е необходим по-нисък (по-отрицателен) потенциал от стандартния електроден потенциал, за да протече даден процес на катода. При водорода свръхнапрежението често е голямо, което прави отделянето на доста метали из воден разтвор възможно.
Казаното дотук важи и за анода, но с обратен знак. Там протича първо процесът с по-нисък (по-отрицателен) потенциал, като посочените в таблицата полуреакции се извършват от дясно наляво (окисление). Поради свръхнапрежение понякога редът на реакциите се променя: т. напр. е възможно отделянето на хлор (U = 1,359 V) от водни разтвори на хлориди, въпреки че отделянето на кислород по горната реакция има по-нисък електроден потенциал (U = 1,229 V).
Понеже на електродите може да се приложи произволно напрежение, на катода могат да се редуцират дори и най-силните редуктори, а на анода да се окислят дори и най-силните окислители. Затова се казва че катодът е най-силният редуктор, а анодът – най-силният окислител. Едва след откриването на електролизата станало възможно получаването на силни редуктори (напр. натрий, калий) и силни окислители (напр. хлор, флуор).
Основни зависимости
[редактиране | редактиране на кода]За да се обменят един мол електрони е необходим електрически заряд от 96485 кулона. Това се равнява числено на т.нар. константа на Фарадей F = 96485 C/mol. Електрическото съпротивление на електролизната клетка трябва да е възможно най-ниско. В противен случай голяма част от електрическата енергия се губи под формата на топлина. Електрическото съпротивление при електролизата е правопропорционално на разстоянието между електродите и обратнопропорционално на площта на електродите и специфичната проводимост на разтвора. По тази причина площта на електродите трябва да е възможно най-голяма при минимално разстояние между тях. Към електролита често се добавя киселина, основа или сол с цел да се повиши специфичната проводимост на разтвора.
Приложение
[редактиране | редактиране на кода]Електролизата се използва широко в промишлеността. При така наречената хлоралкална електролиза се получават различни продукти според условията при които се провежда процеса: водород, натриева основа, хлор, натриев хипохлорит (белина), натриев хлорат, солна киселина и други. Като суровина за този процес се използва воден разтвор на натриев хлорид (каменна или морска сол или директно морска вода). Прилага се също и за нанасяне на метални и неметални покрития (поцинковане, никелиране, хромиране, позлатяване и др.).
Получаването на чиста мед (електролитна мед) е друг типичен пример.
Електролизата е на практика единственият практически метод за получаване на алуминий. За целта се пропуска електрически ток през стопилка на алуминиеви соли.
Електролизата се използва и при различни органични синтези. При това органичните съединения се окисляват/редуцират директно на електрода или реагират с продукти отделени при електролизата (напр. водород).



