Изолевцин
| Изолевцин | |
 | |
| Имена | |
|---|---|
| По IUPAC | Изолевцин |
| Други | 2-амино-3-метилпентанова киселина |
| Свойства | |
| Формула | C6H13NО2 |
| Моларна маса | 131.17 g/mol |
| pKa | 9,758 |
| Идентификатори | |
| CAS номер | 73-32-5 |
| PubChem | 791 |
| ChemSpider | 6067 |
| DrugBank | DB00167 |
| KEGG | D00065 |
| MeSH | D007532 |
| ChEBI | 17191 |
| ChEMBL | CHEMBL1233584 |
| SMILES | CC[C@H](C)[C@@H](C(=O)O)N |
| InChI | InChI=1S/C6H13NO2/c1-3-4(2)5(7)6(8)9/h4-5H,3,7H2,1-2H3,(H,8,9)/t4-,5-/m0/s1 |
| InChI ключ | AGPKZVBTJJNPAG-WHFBIAKZSA-N |
| UNII | 04Y7590D77 |
| Gmelin | 486381 |
| Данните са при стандартно състояние на материалите (25 °C, 100 kPa), освен ако не е указано друго. | |
| Изолевцин в Общомедия | |
Изолевцин (съкратено Ile или I)[1] е α-аминокиселина с химическа формула HO2CCH(NH2)CH(CH3)CH2CH3. Тя е незаменима аминокиселина, което означава, че човешкият организъм не може да я синтезира и тя трябва да се набавя с храната. Нейните кодони са AUU, AUC и AUA.
С въглеводородна странична верига изолевцина се класифицира като хидрофобна аминокиселина. Наред с треонина изолевцинът е една от двете аминокиселини, притежаващи хирална странична верига. Възможни са четири стереоизомера на изолевцина, включително два диастереоизомера на L-формата. Въпреки всичко, естествената форма на изолевцина в природата е енантиомера (2S,3S)-2-амино-3-метилпентанова киселина.
Катаболизъм[редактиране | редактиране на кода]
Изолевцинът е едновременно глюкогенна и кетогенна аминокиселина. След трансаминиране с алфа-кетоглутарат въглеродния скелет може да се преобразува в сукцинил-КоА или да се включи в цикъла на Кребс за окисление или превръщане в оксалоацетат, участващ в глюконеогенезата (оттук глюкогенен). Също така изолевцинът може да бъде превърнат в ацетил-КоА и включен в цикъла на Кребс чрез кондезиране с оксалоацетат до образуване на цитрат. При бозайниците ацетил-КоА не може да бъде превърнат обратно до въглехидрат, но може да бъде използван в синтезата на кетонни тела или мастни киселини (оттук кетогенен).
Биотин, понякога известен и като Витамин B7 или Витамин H, е абсолютно необходим за пълния катаболизъм на изолевцина (както и на левцина). Без необходимия биотин човешкото тяло не може напълно да разгради молекулите на изолевцина и левцина.[2]
Нарушената обмяна на двете аминокиселини може да доведе до физиологични промени (свързани с мускулите и протеиновия синтез, липидния метаболизъм, както и метаболизма на мастните киселини), когнитивни нарушения произхождащи от общ метаболитен недостиг, както и от дразнещите ефекти на хидроксиизовалерата – страничен продукт от непълния катаболизъм на изолевцина. Изовалератна ацидемия е пример за заболяване причинено от непълния катаболизъм на левцин.
Хранителни източници[редактиране | редактиране на кода]
Въпреки че тази аминокиселина не се продуцира от животните, тя се съхранява в големи количества. Храни съдържащи високо количество изолевцин са яйцата, соевия протеин, водораслите, пуешкото, пилешкото и агнешкото месо, сиренето и рибата.[3]
Изомери[редактиране | редактиране на кода]
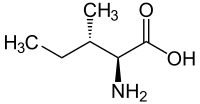  |
| L-изолевцин (2S,3S) и D-изолевцин (2R,3R) |
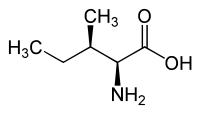  |
| L-ало-изолевцин (2S,3R) и D-ало-изолевцин (2R,3S) |
Източници[редактиране | редактиране на кода]
- ↑ IUPAC-IUBMB Joint Commission on Biochemical Nomenclature. Nomenclature and Symbolism for Amino Acids and Peptides // Recommendations on Organic & Biochemical Nomenclature, Symbols & Terminology etc. Посетен на 17 май 2007.
- ↑ www.metametrix.com // Архивиран от оригинала на 2013-10-19. Посетен на 2012-04-06.
- ↑ List is in order of highest to lowest of per 200 Calorie serving of the food, not volume or weight
| Тази страница частично или изцяло представлява превод на страницата Isoleucine в Уикипедия на английски. Оригиналният текст, както и този превод, са защитени от Лиценза „Криейтив Комънс – Признание – Споделяне на споделеното“, а за съдържание, създадено преди юни 2009 година – от Лиценза за свободна документация на ГНУ. Прегледайте историята на редакциите на оригиналната страница, както и на преводната страница, за да видите списъка на съавторите.
ВАЖНО: Този шаблон се отнася единствено до авторските права върху съдържанието на статията. Добавянето му не отменя изискването да се посочват конкретни източници на твърденията, които да бъдат благонадеждни. |
| |||||

