Амоняк
| Амоняк | |||||
| |||||
| Имена | |||||
|---|---|---|---|---|---|
| По IUPAC | Азан | ||||
| Други | Азотен трихидрид | ||||
| Структура | |||||
| Молекулна форма | триъгълна пирамида | ||||
| Свойства | |||||
| Формула | NH3 | ||||
| Моларна маса | 17.031 g/mol | ||||
| Външен вид | безцветен газ с остра дразнеща миризма | ||||
| Плътност | 817 kg/m3 при −80 °C | ||||
| Точка на топене | −77.73 °C | ||||
| Точка на кипене | −33.34 °C | ||||
| Парно налягане | 860 000 Pa (20 °C) | ||||
| Разтворимост във вода | 47% (0 °C) 31% (25 °C) 28% (50 °C) | ||||
| pKa | 32.5 (−33 °C) | ||||
| pKb | 4.75 | ||||
| Диполен момент | 1.42 D | ||||
| Термохимия | |||||
| Стандартна енталпия на образуване | −45,94 kJ/mol | ||||
| Стандартна моларна ентропия | 192,5 J/(mol·K) (газ)[1] | ||||
| Опасности | |||||
| ЕС класификация | |||||
| ЕС индекс | 007-001-00-5 (безводен) 007-001-01-2 (разтвор) | ||||
| Фрази за риск | R10, R23, R34, R50 | ||||
| Фрази за безопасност | (S1/2), S9, S16, S26, S36/37/39, S45, S61 | ||||
| NFPA 704 |
| ||||
| Точка на самозапалване | 651 °C | ||||
| LD50 | 7 g/m³ (1 h; заек подземник) 9859 (1 h; заек подземник) | ||||
| Сродни съединения | |||||
| Сродни катиони | Арсен | ||||
| Други | Амониев хидроксид | ||||
| Идентификатори | |||||
| CAS номер | 7664-41-7 | ||||
| PubChem | 222 | ||||
| ChemSpider | 217 | ||||
| Номер на ЕК | 231-635-3 | ||||
| Номер на ООН | 1005 | ||||
| DrugBank | DB11118 | ||||
| KEGG | D02916 | ||||
| MeSH | Ammonia | ||||
| ChEBI | 16134 | ||||
| ChEMBL | CHEMBL1160819 | ||||
| RTECS | BO0875000 | ||||
| SMILES | N | ||||
| InChI | 1/H3N/h1H3 | ||||
| InChI ключ | QGZKDVFQNNGYKY-UHFFFAOYSA-N | ||||
| Beilstein | 3587154 | ||||
| UNII | 5138Q19F1X | ||||
| Gmelin | 79 | ||||
| 3DMet | B00004 | ||||
| Данните са при стандартно състояние на материалите (25 °C, 100 kPa), освен ако не е указано друго. | |||||
| Амоняк в Общомедия | |||||
Амонякът е газ с остра характерна миризма. По-лек от въздуха, добре разтворим във вода и лесно втечним при високо налягане. Състои се от 1 атом азот и 3 атома водород, има молекулна формула NH3. Азотният атом е свързан с водородните атоми с полярни ковалентни връзки. Тези връзки са полярни, защото електроотрицателността на азота е по-голяма от тази на водорода. Молекулата на амоняка е полярна поради полярните ковалентни връзки и несиметричния ѝ строеж. При азотния атом има свободна електронна двойка.
Структура
[редактиране | редактиране на кода]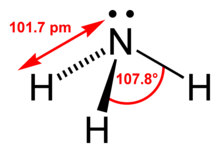
Молекулата на амоняка не е плоска, а отговаря на триъгълна пирамида. Тя е производна на тетраедър, като свободната електронна двойка на азота заема единия връх.
Свойства
[редактиране | редактиране на кода]Физични свойства
[редактиране | редактиране на кода]Амонякът NH3 е безцветен газ с остра характерна миризма. По-лек от въздуха, добре разтворим във вода и лесно втечним при високо налягане. Плътността му спрямо въздуха е 0,59.
При обикновена температура и повишено налягане амонякът лесно се втечнява. Течният амоняк лесно се изпарява, като поглъща голямо количество топлина от околната среда, в резултат на което я охлажда. Затова амонякът широко се използва в хладилната техника.
Амонякът е много добре разтворим във вода, поради образуването на водородни връзки между неподелената електронна двойка при азотния атом и водородните атоми от молекулата на водата. Водният разтвор с масова част на амоняка 25% се нарича амонячна вода.
Образува хидратите NH3.H2О и 2NH3.H2О. Съществуването на NH4ОН все още не се приема еднозначно.
Химични свойства
[редактиране | редактиране на кода]Амонякът не само се разтваря във вода, а и химически се свързва с нея. Водният разтвор на амоняка притежава основен характер и променя цвета на лакмуса в син. Азотните атоми от молекулите на амоняка свързват чрез свободните си електронни двойки водородните йони, получени при дисоциацията на водата. Така се образуват сложни положителни амониеви йони (NH4+). В разтвора остават свободни хидроксидни йони (OH-), които определят основния характер на разтвора:
NH3 + H2O → NH4OH
С киселини амонякът взаимодейства по начин, аналогичен на взаимодействието с вода. Получават се соли, наречени амониеви. При тях връзката между амониевия и киселинния йон е йонна:
NH3 + HCl → NH4Cl
При обикновени условия амонякът не реагира нито с кислорода, нито с въздуха. При загряване обаче образува експлозивни смеси. Струя от амоняк гори в среда от чист кислород. В зависимост от условията на взаимодействие се получават различни продукти. За практиката голямо значение има реакцията на каталитично окисляване на амоняка, при което се образува NO:
4NH3 + 5O2 → 4NO + 6H2O + Q
Получаване
[редактиране | редактиране на кода]Лабораторно амонякът се получава при взаимодействието на амониев хлорид (NH4Cl, нишадър) с натриева (NaOH) или калциева основа (Ca(OH)2). Процесът се ускорява при загряване:
NH4Cl + NaOH → NH3 + H2O + NaCl
При загряване на амонячна вода също може да се получи амоняк.
Директна синтеза (синтез на Хабер-Бош)
[редактиране | редактиране на кода]Промишлено газът се получава чрез пряк синтез – от азот и водород. Катализатор на реакцията е желязо двойно промотирано от K2O и Al2O3. Реакцията протича при температура между 300 – 550 °C и при повишено налягане (р = 15 – 25 MPa).
N2 + 3H2 ⇌ 2NH3
Тъй като правата реакция е екзотермична, в съгласие с принципа на Льо Шателие-Браун загряването я потиска и се намалява синтезата на амоняк и би следвало да се избягва. Не трябва да се забравя обаче, че азотната молекула е извънредно инертна поради наличието на здрава тройна връзка между двата атома (N≡N), така че високата температура все пак се налага поради необходимостта тази молекула да бъде активирана. Така повишаването на температурата наистина частично снижава добива на амоняк, но значително ускорява производството му.
При преработка на каменни въглища като отпаден продукт се получава амоняк. Така той се изхвърля във въздуха.
Приложение
[редактиране | редактиране на кода]Амонячната вода се използва в медицината. При загубване на съзнание на пострадалия се дава за много кратко време да вдишва през носа амоняк. При ухапване от насекоми местата се намазват с амонячна вода, която действа като противоотрова. В бита амонячната вода се употребява за пране на цветни тъкани, премахване на петна, избелване на найлони и коприна.
Амонякът се използва за получаване на азотна киселина, минерални торове, пластмаси, багрила, лекарства. Широко приложение намира в хладилната техника, медицината и др. Събира се в метални балони, боядисани в жълто.
При отравяне
[редактиране | редактиране на кода]Вдишването на амоняк при високи концентрации може да причини отравяне[2].
При отравяне с амоняк се препоръчва чист въздух, вдишване на водна пара с прибавка на оцет, пиене на топло мляко, минерална вода. При поражение на кожата тя се измива с чиста вода и се поставят компреси от 5-процентов разтвор на оцет. Може да се използва и 5-процентов разтвор на лимонена киселина.
Източници
[редактиране | редактиране на кода]- ↑ chem.libretexts.org // Посетен на 25 януари 2019 г.
- ↑ Фердман Д.Л., Лепахин В.К., Марченко Е.Н., Швайкова М.Д. Амоняк (Аммиак) // Голямата медицинска енциклопедия (в 30 тома). 3 издание. Т. 1. А – Антибиоза (А – Антибиоз). Москва, Издателство „Съветска енциклопедия“, 1974. с. 576. Посетен на 1 юни 2018. (на руски) ((ru))



