Метионин
| Метионин | |
  | |
| Имена | |
|---|---|
| По IUPAC | Метионин |
| Други | 2-амино-4-(метилтио)бутанова киселина |
| Свойства | |
| Формула | C5H11NО2S |
| Моларна маса | 149.21 g/mol |
| Външен вид | бял кристален прах |
| Плътност | 1.340 g/cm3 |
| Точка на топене | 281 °C разлагане |
| Разтворимост във вода | разтворим |
| pKa | 2,29 |
| Идентификатори | |
| CAS номер | 59-51-8 |
| PubChem | 876 |
| ChemSpider | 853 |
| DrugBank | DB00134 |
| KEGG | D04983 |
| MeSH | D064697 |
| ChEBI | 16811 |
| ChEMBL | CHEMBL274119 |
| ATC | QA05BA90, QG04BA90 V03AB26, QA05BA90, QG04BA90 |
| SMILES | CSCCC(C(=O)O)N |
| InChI | InChI=1S/C5H11NO2S/c1-9-3-2-4(6)5(7)8/h4H,2-3,6H2,1H3,(H,7,8) |
| InChI ключ | FFEARJCKVFRZRR-UHFFFAOYSA-N |
| UNII | 73JWT2K6T3 |
| Gmelin | 3117 |
| Данните са при стандартно състояние на материалите (25 °C, 100 kPa), освен ако не е указано друго. | |
| Метионин в Общомедия | |
Метионин (съкратено Met или M)[1] е α-аминокиселина с химическа формула HO2CCH(NH2)CH2CH2SCH3. Тя се класифицира като неполярна незаменима аминокиселина. Кодира се от кодона AUG, още известен като старт кодон, тъй като показва от къде започва транслирането на протеина от иРНК. Изпълнява главна роля в процесите на репродукция, клетъчното оцеляване, метилирането на протеините и на ДНК. Метионинът и цистеинът са единствените две аминокиселини, съдържащи серен атом.
Биологични функции
[редактиране | редактиране на кода]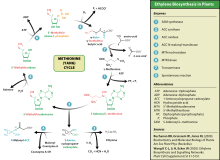
Метионинът има важно значение за биосинтеза на протеините, защото почти всички полипептидни вериги започват с включване на метионин в N-края си. Освен това метионинови остатъци могат да бъдат включени и вътре в полипептидната верига. Началният метионин най-често бива отстраняван в процеса на посттранслационна модификация на протеините от специфичен ензим наречен метионин аминопептидаза.
Неговото производно S-аденозилметионин служи като донор на метилови групи, оттам и важната роля на метионина в клетъчните процеси на метилиране. Метионинът е междиненен продукт в биосинтеза на цистеин, карнитин, таурин, лецитин, фосфатидилхолин, както и други фосфолипиди. Неправилното превръщане на метионина може да доведе атеросклероза.[2]
Тази аминокиселина също се използва от растенията и за синтезиране на важния за тяхното развитие фитохормон етилен. Този процес е известен като цикъл на Янг или цикъл на метионина.
Друго приложение на метионина е като антидот при предозиране с парацетамол: 100 мг метионин за 500 мг парацетамол.
При проучване върху плъхове на диета без метионин се установява развитие на стеатохепатит. Приемането на метионин подобрява патологичните нарушения вследствие от диетата.[3]
Бетаини
[редактиране | редактиране на кода]
Синтез
[редактиране | редактиране на кода]Рацемичен метионин може да се синтезира от диетилнатриев фталимидомалонат чрез алкилиране с хлоретилметилсулфид (ClCH2CH2SCH3) последвано от хидролиза и декарбоксилиране.[4]
Биохимия
[редактиране | редактиране на кода]Въпреки невъзможността на бозайниците да синтезират метионин те все пак могат да го използват в различни биохимични пътеки.
Образуване на хомоцистеин
[редактиране | редактиране на кода]Метионинът се трансформира до S-аденозилметионин (SAM) от ензима (1) метионин аденозилтрансфераза. SAM служи като донор на метилови групи в много (2) метилтрансферазни реакции, превръщайки се в S-аденозилхомоцистеин (SAH). Ензимът (3) аденозилхомоцистеиназа превръща SAH в хомоцистеин. Хомоцистеинът може да продължи по два пътя: да възстанови метионина или да образува цистеин.
Възстановяване на метионина
[редактиране | редактиране на кода]Метионинът може да бъде възстановен от хомоцистеин чрез ензима (4) метионин синтетаза в реакция, изискваща кофактор витамин B12.
Превръщане в цистеин
[редактиране | редактиране на кода]Хомоцистеинът може да се превърне в цистеин.
- (5) цистатионин-β-синтетаза комбинира хомоцистеин и серин, за да образува цистатионин. След това цистатионинът се разпада до цистеин и α-кетобутират чрез ензима (6) цистатионин-γ-лиаза.
- (7) α-кетобутират дехидрогеназа превръща α-кетобутирата в пропионил-КоА, който се метаболизира до сукцинил-КоА в тристепенен процес.
Серният атом в структурата на аминокиселината е чувствителен на окисление, поради което могат да се образуват две производни: метионин сулфоксид и метионин сулфон.
Роля на витамин B12
[редактиране | редактиране на кода]Той участва като кофактор във възстановяването на метионина. В действителност витамин B12 участва със своята метилирана форма като метил-B12, като по този начин осигурява метилирането на хомоцистеина до метионин. Донор на метилова група за витамин B12 е метилтетрахидрофолат (метил-ТХФ), участващ в метаболизма на фолиевата киселина. Следователно трябва да се отбележи, че тъй като витамин В12 е важен за синтеза на ДНК, недостигът му може да доведе до тежки нарушения при деленето на бързоделящи се клетки, например в костия мозък, водещо до развитие на макроцитоза и мегалобластна анемия.
Хранителни източници
[редактиране | редактиране на кода]| Храни | г/100г |
|---|---|
| Яйца, на прах | 3.204 |
| Сусам, брашно (нискомаслено) | 1.656 |
| Яйца, сурови | 1.477 |
| Сирене | 1.114 |
| Бразилски орех | 1.008 |
| Соев протеин, концентрат | 0.814 |
| Пиле | 0.801 |
| Риба | 0.755 |
| Телешко месо | 0.749 |
| Бекон | 0.593 |
| Свинско месо | 0.564 |
| Пшеничен зародиш | 0.456 |
| Овес | 0.312 |
| Фъстък | 0.309 |
| Леблебия | 0.253 |
| Царевица | 0.197 |
| Бадем | 0.151 |
| Боб | 0.117 |
| Леща, сготвена | 0.077 |
| Ориз, кафяв, сготвен | 0.052 |
Високо съдържание на метионин се намира в яйцата, сусама, рибата, различни видове меса, почти всички зърнени храни в различни количества и съотношения с други аминокиселини. Повечето плодове и зеленчуци са бедни на метионин, както и повечето бобови растения. Широко използвана комбинация от растителни източници осигуряващи протеиновите нужди е съчетаването на зърнени (метионин) с бобови (лизин) храни.[6]
Източници
[редактиране | редактиране на кода]- ↑ Nomenclature and symbolism for amino acids and peptides (IUPAC-IUB Recommendations 1983). – Pure Appl. Chem., 56(5), 595–624, 1984, doi:10.1351/pac198456050595.
- ↑ Refsum H, Ueland PM, Nygård O, Vollset SE. Homocysteine and cardiovascular disease. Annual review of medicine, 1998, 49(1), pp.31-62.
- ↑ Oz HS, Chen TS, Neuman M. Methionine deficiency and hepatic injury in a dietary steatohepatitis model. Digestive Diseases and Sciences. Т. 53. 2008. DOI:10.1007/s10620-007-9900-7. с. 767–776.
- ↑ dl-Methionine // Org. Synth 14. 1934. с. 58.; Coll. Vol., 2, 384.
- ↑ National Nutrient Database for Standard Reference. U.S. Department of Agriculture. Посетен на 7 септември 2009. Архив на оригинала от 2015-03-03 в Wayback Machine..
- ↑ Nutritional Value Архив на оригинала от 2010-09-16 в Wayback Machine. – Idaho Bean Commission
| |||||
| Тази страница частично или изцяло представлява превод на страницата Méthionine в Уикипедия на френски. Оригиналният текст, както и този превод, са защитени от Лиценза „Криейтив Комънс – Признание – Споделяне на споделеното“, а за съдържание, създадено преди юни 2009 година – от Лиценза за свободна документация на ГНУ. Прегледайте историята на редакциите на оригиналната страница, както и на преводната страница, за да видите списъка на съавторите.
ВАЖНО: Този шаблон се отнася единствено до авторските права върху съдържанието на статията. Добавянето му не отменя изискването да се посочват конкретни източници на твърденията, които да бъдат благонадеждни. |
| Тази страница частично или изцяло представлява превод на страницата Methionine в Уикипедия на английски. Оригиналният текст, както и този превод, са защитени от Лиценза „Криейтив Комънс – Признание – Споделяне на споделеното“, а за съдържание, създадено преди юни 2009 година – от Лиценза за свободна документация на ГНУ. Прегледайте историята на редакциите на оригиналната страница, както и на преводната страница, за да видите списъка на съавторите.
ВАЖНО: Този шаблон се отнася единствено до авторските права върху съдържанието на статията. Добавянето му не отменя изискването да се посочват конкретни източници на твърденията, които да бъдат благонадеждни. |

