Твърдо тяло

Твърди тела се наричат тези вещества, които могат да запазват непроменени формата и обема си достатъчно дълго време. В зависимост от вътрешния си строеж, който обуславя и свойствата им, те се делят на две основни групи – кристални и аморфни. В кристалните атомите са разположени плътно един до друг и образуват кристална решетка с определено подреждане. В аморфните (например стъклото) атомите нямат определено подреждане. Делът от физиката, който се занимава с тяхното изучаване, се нарича Физика на твърдото тяло, и по-точно Физика на кондензираната материя. Физиката на твърдото тяло се занимава с физика на материята в твърдо състояние, като специален случай на кондензираната материя. Материалознанието се занимава предимно с физичните и химични свойства на твърдите тела. Химията на твърдото тяло, в допълнение на химичния състав на веществата, се интересува и от синтеза на нови материали. Дисциплини като минералогия, металургия и кристалография също се занимават с изучаване на твърдите тела.
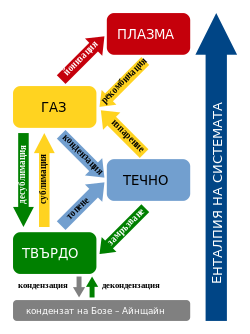
Твърдо агрегатно състояние
[редактиране | редактиране на кода]Твърдо се нарича агрегатното състояние на веществото, характеризиращо се със способността да запазва обема и формата си. Атомите на телата в твърдо агрегатно състояние извършват само слаби трептения около равновесното си състояние[1]. В зависимост от това как са подредени атомите в твърдите тела, се наблюдава по-голяма подреденост (далечен порядък) и по-малка (близък порядък) и веществата се делят съответно на кристални и аморфни.
Твърдите вещества могат да се превръщат в течност чрез топене, а течностите да преминават в твърдо състояние чрез замразяване. Директният преход на твърдо вещество в газ се нарича сублимация.
Кристални вещества
[редактиране | редактиране на кода]
Кристалните вещества са твърди вещества, изградени от кристална решетка. Атомите, молекулите или йоните са опаковани в правилна, повтаряща се форма. Съществуват различни типове кристални решетки и едно и също вещество може да има повече от една кристална решетка. Например желязото има централно-центрирана кубична решетка при температури под 912 °C и стенно-центрирана кубична решетка при температури между 912 °C и 1394 °C. Ледът има 15 известни кристални решетки, които съществуват при различни температура и налягане.
Кристал се нарича твърдо тяло, ограничено от плоски стени, които сключват помежду си определен ъгли. Важно свойство на кристалите, което ги отличава от другите тела с правилна геометрична форма е анизотропията – зависимостта на някои физични и химични свойства от направлението на приложеното въздействие. Например за разрушаване на кристал графит или слюда в една равнина е необходима по-малка сила отколкото перпендикулярно направление.
Друга важна особеност на кристалите е точно определената температура на топене. При нея свойствата на веществото се променят скокообразно – от твърдо става течно или обратно.
Идеални кристали
[редактиране | редактиране на кода]


Анизотропията на кристалните вещества се дължи на тяхната вътрешна структура. Чрез дифракция на рентгенови лъчи от различни видове кристали е доказано експериментално, че те са изградени от правилно подредени в пространството частици, които образуват т.нар. кристална решетка. Това е присъщо на кристалното състояние на веществата правилно разположение на частиците (атоми, йони, молекули), което се повтаря периодично в трите измерения на пространството. По този начин кристалната решетка може да се разглежда като получена чрез многократна транслация по трите координатни оси на правоъгълна координатна система на една геометрична фигура, образувана от изграждащите кристалната решетка частици, наречена елементарна клетка. Кристалната решетка се характеризира със своето координационно число. То представлява броят на най-близките съседи в кристалната решетка. Обикновено то е 6, 8 или 12.
Някои вещества в зависимост от условията на кристализиране могат да изграждат различни видове кристална решетка. Явлението се нарича полиморфизъм. Обикновено преходът от една полиморфна форма в друга е твърде бавен, поради което при определени условия могат да бъдат практически устойчиви две или повече полиморфни форми.
Друго свойство на кристалите е изоморфизъм. Това е способност на различни вещества да образуват кристали с еднаква по форма и близка по размери елементарна клетка. Такива вещества се наричат изоморфни. При едновременно изкристализиране от общ разтвор, те образуват обща кристална решетка.
Кристалните решетки се разделят на няколко вида в зависимост от вида на частиците, които се намират във възлите на елементарната решетка и от характера на химичните връзки между тях.
- Атомната кристална решетка е изградена от един или няколко вида атоми, свързани помежду си с ковалентни химични връзки. Целият кристал може да се разглежда като една гигантска молекула. Атомни кристални решетки притежават диамантът, някои от алотропните модификации на силиция, германия, калая, накои фосфиди, арсениди, нитриди и др. Някои от тях проявяват полупроводникови свойства. В атомните кристали частиците са ориентирани по посока на химичната връзка. Поради това в тях невинаги се спазва принципът за най-плътна опаковка, който е определящ за йонните и метални кристални решетки. Веществата с атомна кристална решетка са високотопими, твърди, крехки и неразтворими.
- Йонната кристална решетка е изградена от положително и отрицателно заредени йони. Такава решетка могат да образуват само сложните вещества, състоящи се от елементи с голяма разлика в електроотрицателността. Йонна е и връзката в кристали, изградени от сложни йони – NaSO4, NH4Cl, (NH4)2SO4 и други.
В кристалната решетка всеки йон е обграден от йони с противоположен заряд и привличането преобладава пред отблъскването. Електростатичните сили между йоните са твърде големи, поради което йонните кристални вещества са твърди и високотопими.
При ниски температури йонните кристали не провеждат електрически ток, защото практически всички електрони са локализирани в йоните, а йонната проводимост, дължаща се на дефекти в кристалната решетка, е незначителна. В стопилка или във воден разтвор йонните съединения добре провеждат електрически ток, поради наличието на електрически заредени частици. Химичната връзка в йонните кристали не е насочена и не може да се насища. Поради това всеки йон се стреми да се обгради с максимален брой противоположно заредени йони. Техният брой зависи от отношението на радиусите на двата вида йони.
Характерна особеност на атомната и йонната кристална решетка е, че за тях не важи понятието молекула. Кристалът е едно цяло и в зависимост от големината си съдържа различен, но винаги много голям брой частици.
- Металната кристална решетка е изградена само от катиони. Стабилността ѝ е обособена от особен вид химична връзка, присъща само на металите в твърдо и течно агрегатно състояние. Металите притежават редица общи свойства: висока електро- и топлопроводимост, висока пластичност, способност да отразяват голяма част от падналите върху тях светлинни лъчи, които не са присъщи на останалите кристални тела. Тези физични характеристики на металите се дължат на свободно движещите се в металните кристали електрони.
Взаимодействието между свободните електрони и намиращите се във възлите на кристалната решетка катиони не е насочено и не се насища. Поради това металите кристализират в такъв тип кристална решетка, който осигурява максимално плътно подреждане на катионите.
- В молекулната кристална решетка градивната единица е молекулата. Отделните молекули са свързани помежду си с водородни или междумолекулни връзки, които са много по-слаби от другите видове химична връзка. Поради това молекулните кристали имат малка здравина и ниска температура на топене. Кристали от такъв тип образуват повечето вещества с ковалентна химична връзка, които при обикновена температура са газообразни, както и кристалите на повечето органични съединения.
Известна е група кристални вещества, които имат в кристалната си решетка едновременно два вида химична връзка. Това са кристали със смесени връзки. Такъв кристал е например ледът (помежду си молекулите на водата са свързани с водородни и междумолекулни връзки) или графитът (връзките в един слой са ковалентни, а между отделните слоеве се движат свободни електрони, което обуславя металната химична връзка).
Реални кристали
[редактиране | редактиране на кода]Разгледаните дотук кристални решетки не отчитат факта, че при практическото получаване на един кристал, в неговата структура винаги се създават и редица неправилности, наричани дефекти на кристалната решетка. Твърде често те оказват голямо влияние върху практически важни свойства на кристалните тела – здравина, електропроводимост, пластичност, магнитна възприемчивост и др. В редица случаи наличието на дефекти в кристалната решетка придава нови свойства – повишена твърдост, полупроводникови характеристики и други.
Дефектите възникват по различни причини. При кристализацията частиците образуват решетката с голяма скорост и вследствие на хаотичното топлинно движение е възможно в един възел да застанат две частици или там да остане свободно място. Дефекти могат да се образуват и в резултат на хаотичното трептене на частиците около възлите на кристалната решетка или в резултат на пластична деформация на решетката. Ако тази деформация надхвърли границата на пластичност на материала, в него ще се появят пукнатини и той ще започне да се разрушава.
Друг вид дефекти в кристалната решетка се дължат на присъствието на примесни атоми, йони или молекули. По принцип получаването на абсолютно чисто вещество е възможно само теоретично. В редица случаи влиянието на примесите е незначително и може да се пренебрегне, но в някои случаи те оказват влияние върху свойствата на кристала, например съдържанието на стотни от процента арсен или сяра в стоманата влошава нейните механични качества. Влиянието на дефектите е толкова по-голямо, колкото е по-голямо тяхното количество. То се измерва с брой дефекти на 1 cm3 от веществото или с брой дефекти на 1 cm2 от повърхността на кристала.
Дефектите биват точкови, примесни и линейни. Точковите дефекти представляват отсъствие на частица от възел на кристалната решетка или наличие на частица между възлите на решетката. Незает възел се нарича ваканция. Чрез ваканциите се обяснява електропроводимостта на йонните кристали. Чрез точковите дефекти се обяснява и съществуването на редица кристални вещества с променлив стехиометричен състав. Например в зависимост от начина на кристализиране кристалите на титановия оксид могат да имат състав от TiO0,6 до TiO1,35. Излишъкът на атоми титан отговаря на ваканциите кислород и обратно.
Повечето съвременни полупроводници представляват кристали с изкуствено създадени примесни дефекти, например ако в кристалната решетка на силиция се вгради алуминий, то ще се получи полупроводник с дупчеста проводимост, а ако примесът е арсен – с електронна проводимост.
Линейните дефекти се наричат още и дислокации. Представляват нарушаване на мястото на цяла група частици, разположени около някаква ос в кристала. Обикновено тяхната концентрация в кристала е 105-107 за 1 cm3. Дислокациите биват линейни и винтови. При прилагане на механично усилие дислокациите могат да се движат в кристала и с това той се деформира пластично.
Аморфни вещества
[редактиране | редактиране на кода]

Аморфните вещества се характеризират с отсъствие на строга закономерност в подреждането на техните градивни частици една спрямо друга на далечно разстояние. В структурата на аморфните вещества съществува само близък порядък, т.е. съгласуваност в разположението само на съседни частици, която с увеличаване на разстоянието отслабва и изчезва. Такъв близък порядък се наблюдава и при течностите, като по своята структура и свойства аморфните вещества се доближават до тях. В течностите обаче се извършва интензивен топлообмен на местата на съседните частици, който се затруднява с нарастване на вискозитета. Затова понякога аморфните вещества се разглеждат като течности с много голям вискозитет. Подобно на течностите аморфните тела са идентични във всяка точка т.е. те са изотропни. Освен това те нямат точно определена температура на топене и при повишаване на температурата се размекват и постепенно преминават в течно състояние.
В редица случаи едно и също вещество може да съществува в кристално и в аморфно състояние. Например SiO2 в аморфно състояние съществува като ахат и опал, а в кристално като кварц, кристобалит, тридимит и още четири кристални модификации.
Поради високата си степен на неподреденост веществото в аморфно състояние притежава по-голям запас от енергия в сравнение с кристалното. Поради това аморфното е по-неустойчиво и съществува стремеж за преминаване на аморфните тела в кристални, което води до промени в свойствата на веществата. Този преход е самопроизволен и се извършва с отделяне на известно количество топлина – например при преминаването на аморфния SiO2 в кварц тя е от порядъка на 12 kJ/mol. Пречка при осъществяване на този преход е високият вискозитет на аморфните вещества, поради което той не се наблюдава в редица от случаите.
Типичен пример за аморфни вещества са стъклата и затова понякога аморфното състояние се нарича стъкловидно. Стъкла се наричат всички аморфни вещества, получени чрез преохлаждане на стопилка, независимо от химичния състав. При това бързо охлаждане вследствие на увеличаването на вискозитета те придобиват механичните свойства на типично твърдите тела.
Течни кристали
[редактиране | редактиране на кода]Това са някои органични вещества (напр. калиеви или амониеви олеати), които се характеризират с това, че имат отнасяния на течност и кристално тяло. Наричат се течни кристали, тъй като в течно състояние имат анизотропни свойства. Това означава, че те притежават течливост – образуващите ги частици могат да се преместват свободно една спрямо друга и да заемат формата на съда, в който са поставени. От друга страна тези тела проявяват анизотропия в еластичните, оптичните, електричните и магнитните си свойства. Това се получава вследствие на подреденост в структурата им, която се запазва при тяхното движение.
Видове твърди тела според зонната им структура
[редактиране | редактиране на кода]Основна съвременна теория за строежа на твърдите тела е зонната теория. Тя обяснява природата и най-важните свойства на металите, полупроводниците и диелектриците. Твърдите тела се разделят на проводници, полупроводници и диелектрици въз основа на широчината на забранената зона. Колкото широчината на забранената зона е по-голяма, толкова по-трудно валентните електрони се откъсват от атомите и се превръщат в свободни електрони.
Проводници
[редактиране | редактиране на кода]
Металите обикновено са добри проводници на електричество и топлина. По-голямата част от елементите в периодичната таблица, вляво от диагоналната линия, са метали. Смеси от два или повече елемента, в които основният елемент е метал са известни като сплави.
Хората са използвали металите за различни цели от праисторически времена. Здравината и надеждността им са довели до широкото им използване в строителството на сгради и други структури, както и в повечето превозни средства, много уреди и инструменти, тръби, пътни знаци и железопътни линии. Желязо и алуминий са двата най-често използвани метала. Те също така са най-разпространените метали в земната кора. Желязото се използва най-често под формата на сплав – стомана, която съдържа до 2,1% въглерод, което я прави много по-твърда от чистото желязо.
Защото металите са добри проводници на електричество, те са ценни в електрическите уреди и за пренасяне на електрически ток на дълги разстояния с малки загуби на енергия. По този начин електрическите мрежи разчитат на метални кабели, за да разпределят електрическата енергия. Високата топлопроводимост на повечето метали ги прави полезни също за прибори за готвене, например котлони.
Полупроводници
[редактиране | редактиране на кода]
Полупроводници се наричат вещества, които подобно на металите имат електронна проводимост, но се отличават от тях по това, че броят на носителите на тока е неголям и силно зависи от температурата, осветлението и количеството на примесите. При ниски температури тяхното съпротивление е голямо и при тези условия се проявяват като изолатори. С повишаване на температурата или при осветяване тяхната проводимост се увеличава и може да достигне тази на металите. В полупроводниците за разлика от металите има забранена зона, която обаче е по-малка от тази на изолаторите (диелектриците). Счита се, че ширината на забранената зона в тях се колебае в интервала 0,1 – 3 eV.
При прехода на електрони в зоната на проводимост, във валентната зона остават еквивалентно количество непълно заети енергетични нива – наричат се електрони ваканции или „дупки“. В тях могат да прескачат електрони от близко разположените нива, което предизвиква преместване на тези „дупки“ в направление, обратно на движението на електроните. В отсъствието на външно електрично поле електроните и дупките извършват хаотично движение, а при прилагане на потенциална разлика дупките се движат предимно по посока на полето, а електроните в обратното направление. По този начин проводимостта на полупроводниците се сумира от проводимостта на отрицателните заряди и проводимостта, която е еквивалентна на преместването на положителните заряди. Първата се нарича електронна проводимост (n-тип), а втората – дупчеста проводимост (р-тип). За полупроводници без примеси концентрацията на двата типа носители е една и съща. Това не означава, че техният принос в общата електропроводимост е един и същ, тъй като подвижността им е различна. тази електропроводимост се нарича собствена. За всеки полупроводник съществува определена температура за настъпване на тази проводимост, която е толкова по-висока, колкото е по-голяма ширината на забранената зона. На практика обаче по-важна е проводимостта, която се осъществява в реалните полупроводници, които винаги имат примеси или дефекти в кристалната си структура.
Чрез въвеждането на примеси може да се влияе върху свойствата на полупроводниците, тъй като те изменят съотношението между двата типа проводимост.
Диелектрици
[редактиране | редактиране на кода]Диелектрик (изолатор) е вещество, което не провежда електрически ток. Плътността на свободните носители на електрически заряд в диелектрика не превишава 108 броя на квадратен сантиметър. Към диелектриците могат да се причислят въздуха и другите газове, стъклото, различни смоли и пластмаси. Дестилираната (химически чистата) вода също е диелектрик.
С увеличаване на напрежението диелектричните загуби растат във всички видове диелектрици. При постоянно напрежение диелектричните загуби зависят от съпротивлението на конструкцията. Диелектричните загуби при неполярните диелектрици не зависят от честотата на променливото електрично поле, като диелектричните загуби, дължащи се на забавени поляризации, се проявяват само при променливо електрично поле.
Минерали
[редактиране | редактиране на кода]
Минералите са природни неорганични, в много редки случаи органични продукти, представляващи химични съединения или химични елементи, възникнали в резултат на различни геоложки процеси под високо налягане. Те са съставни части на скалите и рудите, но образуват и собствени находища. Срещат се както в земната кора, така и на други обекти от Слънчевата система и всички небесни тела. Изграждат твърдата част на планетите, спътниците, метеоритите и т.н. Техните химични структури обикновено са строго определени, но съотношението на химичните елементи в тях понякога варира в определени граници.[2]
Минералите са относително еднородни, което се обуславя от определения химичен състав и подреждането на химичните елементи в еднакви структури. Почти всички минерали, с много малко изключения, имат кристална структура, тъй като елементите в тях са подредени в характерни геометрични форми. Колоидните (колоидно-дисперсни) минерали с приета аморфна структура при рентгенографски и електронографски изследвания също имат кристално устройство, но при тях тези структури са с много по-малки размери.[2] По-голямата част от познатите до днес над 4000 минерали са неорганични, но съществуват и органични минерали – например кехлибар.[3] Химичните елементи, които се срещат в природата в естествено състояние, също се определят като минерали.[2][4]
Предполага се, че думата минерал произлиза от термина minera, означаващ къс руда или камък, от който може да се получи някакъв метал. Науката, която се занимава с изучаването на минералите, се нарича минералогия.
Керамика
[редактиране | редактиране на кода]
Керамиката е общото наименование на изделия от неорганични, неметални материали (например глина) и техните смеси с минерални добавки. Изделията се използват за домакински съдове, стенна украса и други. Тя намира приложение в строителството, архитектурата, медицината, науката и дома. Керамичните материали са обикновено оксиди. Модерната керамика се състои от карбиди.
Керамичното инженерство е наука и технология за създаване на твърди керамични материали, части и уреди. Това става или под действието на топлина, или при по-ниски температури с използване на утаечни реакции от химически разтвори. Терминът включва пречистване на суровини, проучването и производството на химични съединения, образуване на компоненти и изучаване на тяхната структура, състав и свойства. Керамичните материали са крехки, твърди, силни при компресия и слаби при усукване.
В по-общ смисъл терминът се използва от 19 век, обхващайки като значение всички грънчарски (груба керамика), майолика и порцеланови (фина керамика) изделия. Думата идва от названието на рог за пиене на вода, откъдето впоследствие така се именуват всички глинени съдове. Същото име носи и квартал в древна Атина, населен предимно с грънчари.
Керамичното производство е първото овладяно от човека химично производство. Керамичните изделия са също така и добри топлоизолатори. Професионално керамика днес се изучава в Троян, Национална гимназия за приложни изкуства „Проф. Венко Колев“ и Национална художествена академия в София.
Полимери
[редактиране | редактиране на кода]Полимерите са високомолекулни съединения, молекулите на които се състоят от голям брой повтарящи се атомни групи, свързани помежду си с ковалентни химични връзки. Броят на мономерните звена в макромолекулите характеризира степента на полимеризация. В зависимост от нея биват синтетични смоли или олигомери. Смолите са твърди или полутечни аморфни органични вещества с неголяма молекулна маса, способни при преработка да се превръщат в нетопими и неразтворими вещества. Полимерите, изградени от еднакви мономерни звена, се наричат хомополимери. Когато във веригата на макромолекулите се съдържат различни мономерни звена, полимерите се наричат съполимери.
Наноматериали
[редактиране | редактиране на кода]
Много от традиционните твърди вещества имат различни свойства, когато се намалят до нанометрови размери. Например, наночастици от обикновено жълто злато и сив силиций са червени на цвят, златните наночастици се топят при много по-ниски температури (~ 300 °C за 2,5 Nm размер) от златните плочи (1064 °C)[5]; метални наножици са много по-здрави от съответните метали.[6][7] Наночастиците намират приложения в областта на енергетиката. Например, платината може да се осигури подобрения като автомобилен катализатор на гориво, както и като протонно-обменна мембрана при горивни клетки. Също така, керамичните оксиди (или металокерамиките) на лантан, церий, манган и никел сега се развиват като твърди горивни клетки. Литий, литиев-титанат и танталови наночастици се прилагат в литиево-йонните батерии. Силициевите наночастици драстично увеличават капацитета за съхраняване на литиево-йонните батерии по време на цикъла разширение/свиване. Силициевите наночастици се използват и в нови форми на слънчеви енергийни клетки. Повечето приложения се ограничават с използването на пасивни наноматериали, като титанов диоксид в слънцезащитни кремове и други козметични продукти, повърхностни покрития[8] и някои хранителни продукти, сребро в хранителни опаковки, облекло, дезинфектанти и битови уреди, цинков оксид в козметични продукти, повърхностни покрития, бои и лакове и цериев оксид като горивен катализатор.
Източници
[редактиране | редактиране на кода]- ↑ Стрелецкий Алексей Владимирович, Наймушина Дарья Анатольевна. Твёрдое тело // РОСНАНО. Архивиран от оригинала на 31 май 2012. Посетен на 8 март 2012.
- ↑ а б в Иван Костов – „Минералогия“/изд. „Техника“/София/1993/ISBN 954-03-0112-2
- ↑ National Geographic/Minerals and Gems
- ↑ The Mineral & Gemstone Kingdom/What Defines a Mineral
- ↑ Buffat, Ph. и др. Size effect on the melting temperature of gold particles // Physical Review A 13 (6). 1976. DOI:10.1103/PhysRevA.13.2287. с. 2287.
- ↑ Walter H. Kohl. Handbook of materials and techniques for vacuum devices. Springer, 1995. ISBN 1-56396-387-6. с. 164 – 167.
- ↑ Shpak, Anatoly P и др. Inherent tensile strength of molybdenum nanocrystals (free-download pdf) // Science and Technology of Advanced Materials 10 (4). 2009. DOI:10.1088/1468-6996/10/4/045004. с. 045004.
- ↑ Kurtoglu, M. E et al. Effect of Calcination Temperature and Environment on Photocatalytic and Mechanical Properties of Ultrathin Sol–Gel Titanium Dioxide Films // Journal of the American Ceramic Society 94. 2011. DOI:10.1111/j.1551-2916.2010.04218.x. p. 1101 – 1108. (на английски)
Външни препратки
[редактиране | редактиране на кода]- Механика на твърдо тяло Архив на оригинала от 2012-07-10 в Wayback Machine.
