Злато
Златото е химичен елемент с атомен номер 79 и означение Au. То е тежък, мек, блестящ и ковък метал. Провежда електричеството. Има яркожълт цвят и блясък, традиционно смятан за привлекателен. Не ръждясва във въздуха и във водата.
Златото е преходен метал. Намира се в период 6, група 11 на периодичната система.При нормални условия е в твърдо агрегатно състояние. То е един от най-слабо активните елементи. По тази причина се среща често в самородна форма – като златни зърна и жили в скалите или в алувиални отлагания. По-рядко е съставна част на химични съединения, образуващи минерали, най-често в съединение с телура.
Златото е устойчиво на действието на най-силните киселини поотделно, но може да бъде разтворено в смес на азотна и солна киселина, наричана по тази причина царска вода. То се разтваря и в алкални разтвори на цианиди, които намират приложение в добивната промишленост, както и в живак, образувайки амалгамни сплави. Златото е неразтворимо в азотна киселина, която разтваря повечето метали, включително среброто. Този факт се използва за установяване на наличието на злато чрез т. нар. киселинна проба.
Още отпреди появата на писана история златото е ценен и много търсен благороден метал, използван като парично средство, в бижутерията и за изработване на различни предмети на изкуството. Намирано е било в пясъчните наноси на реките във вид на безформени зърна и люспи. Златните стандарти са най-често срещаната основа на паричната политика в историята на човечеството до първата половина на XX век, когато започват да отстъпват на фиатните пари.
Количеството злато, добито от началото на човешката история до 2011 г., се оценява на 171 хиляди тона, от които 59 % са произведени след 1950 г.[3] Около 50 % от новопроизведеното злато се използва в бижутерията, 40 % – като инвестиция и 10 % – в промишлеността.[4] Добрата ковкост, проводимост, устойчивостта на корозия и слабата химическа активност правят златото подходящо за различни практически приложения в стоматологията, електрониката и други области
Наименование
[редактиране | редактиране на кода]Българската дума „злато“, както и сродните наименования на метала в повечето славянски и балтийски езици (сърбохърватски, словенски, чешки и словашки: „злато“/„zlato“; руски и украински: „золото“; беларуски: „золата“; полски: „złoto“; латвийски: „zelts“), произлиза от праиндоевропейския корен *g'helto- („жълт“, „зелен“).[5] Със същия произход са и думите „зелен“ и „злак“.[5] Чрез различна промяна на праиндоевропейския корен *g'helto- са образувани и наименованията на златото в повечето германски езици (английски и немски: „gold“; датски и шведски: „guld“; нидерландски: „goud“).[6]
Символът на златото Au е получен от латинското му наименование aurum, което според различни източници означава „жълто“ или „светла зора“, и е родствено с „Аврора“ (Aurora) – утринна заря. Според определенията в съвременните латински речници смисълът на думата aurum се простира само до метала злато.[7]
Откриване
[редактиране | редактиране на кода]Златото е известно на човечеството от IV хил. пр.н.е.[7] Намирано е било в пясъчните наноси на реките във вид на безформени зърна и люспи и е използвано за украшения.
Разпространение
[редактиране | редактиране на кода]Златото е широко разпространено в ниски концентрации във всички вулканични скали. В земната кора то е оскъдно и силно силно разсеяно, заемайки 73-то място по разпространение след елементите. Самородното злато е най-разпространеният златен минерал и е оценен на около 80 % от цялото му количество в земната кора.[7] То е във вид на пясък или зърна в речните утайки от речните скали и във вид на златоносни жили, вградени в кварцови образувания. Самородното злато винаги съдържа от 0,1 % до 4 % Ag, Cu, Fe, Hg и метали от паладиевата група или метали, които имат атомен радиус, близък до златния, замествайки го в кристалната му решетка.[7] Известни са около 20 минерала, между които освен самородното злато са още електрумът, медното, паладиевото и бисмутовото злато и други. Химичните съединения на златото в природата са редки. Главно това са телуридите калаверит AuTe2 – винаги придружен с кварц или пирит,[8] кренерит (Au,Ag)Te2 и силванит AuAgTe4, които имат индустриално значение. Сравнително висока концентрация на злато се среща в някои горещи водни извори.[7]
В морската и океанската вода има сравнително много злато главно във вид на комплексните йони [AuCl2]− и [AuCl4]−.[8]
Физични свойства
[редактиране | редактиране на кода]
Златото е най-ковкият метал – един грам от него може да бъде изкован в лист с площ един квадратен метър. Златното фолио може да бъде направено толкова тънко, че да стане прозрачно, като преминаващата през него светлина е зеленикавосиня, тъй като златото отразява силно жълтото и червеното.[9] Такива полупрозрачни листове отразяват и голяма част от инфрачервената светлина, поради което се използват като инфрачервени щитове във визьорите на топлозащитни костюми и скафандри.[10]
Златото е добър проводник на топлината и електричеството. То има голяма плътност – 19,3 t/m3 (тона на кубичен метър), около 2 пъти по-голяма от плътността на Ag, подобно на Zr – Hf и Nb – Ta.[8] За сравнение плътността на оловото е 11,34 t/m3, а тази на най-тежкия елемент – осмия – е 22,610 t/m3. Златото има коефициент на линейно разширение 0,0000142 K−1 и коефициент на обемно разширение 0,0000426 K−1, а специфичната му топлоемкост e 128 J/(kg·K)
Златото лесно образува сплави с други метали. Това се използва за промяна на твърдостта и други свойства на метала, за контролиране на температурата на топене или за оцветяване в специфични цветове.[11] Дава непрекъснат ред твърд разтвор.[8]
Цвят
[редактиране | редактиране на кода]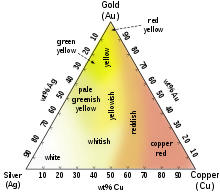
За разлика от повечето метали, които в чист вид са сиви или сребристобели на цвят, златото е жълто. Този цвят се дължи на плътността на слабо свързаните (валентни) електрони, трептящи в обща среда, която може да се разглежда като квазичастица, наричана плазмон. При повечето метали честотата на това трептене е в ултравиолетовия обхват, но при златото е във видимия обхват, поради слабите релативистични ефекти, засягащи орбиталите на неговите атоми.[12][13] На подобни ефекти се дължи и златистият оттенък на цезия.
Сплавите на златото могат да имат различен цвят, както е показано на триъгълната диаграма на сплавите му със среброто и медта. Такова цветно злато намира приложение в бижутерията, където различните цветове се използват с декоративна цел. Например, сплавите на злато с паладий или никел имат бял цвят и намират широко приложение в бижутерията. По-рядко се използват сплави с други елементи, като манган, алуминий, желязо или индий, с които се получават необичайни цветове със специфично приложение.[14]
Изотопи
[редактиране | редактиране на кода]Златото има само един стабилен изотоп, 197Au – единственият срещан в природата. Синтезирани са 36 други радиоактивни изотопа с атомни маси от 169 до 205. Най-устойчив сред тях е 195Au, който има период на полуразпад 186,1 дни. Най-неустойчив е 171Au, при който протича протонен разпад с период на полуразпад 30 µs.
Повечето радиоактивни изотопи на златото с атомна маса под 197 се разпадат чрез съчетание от протонен разпад, алфа-разпад и позитронен бета-разпад (β+). Изключения са 195Au, който се трансформира чрез поглъщане на електрони, и 196Au, при който е налице най-често поглъщане на електрони (93 %) с ограничен електронен бета-разпад (β−).[15] Всички радиоактивни изотопи на златото с атомна маса над 197 се разпадат чрез електронен бета-разпад (β−).[16]
Освен тези изотопи са известни поне 32 ядрени изомера с атомни маси от 170 до 200. В този диапазон само 178Au, 180Au, 181Au, 182Au и 188Au нямат изомери. Най-устойчивият изомер на златото е 198 m2Au с период на полуразпад 2,27 дни, а най-неустойчив е 177 m2Au с период на полуразпад само 7 ns. 184 m1Au има три пътя на разпад: β+ разпад, изомерен преход и алфа-разпад – повече, отколкото всеки друг изомер или изотоп на златото.[16]
Химични свойства
[редактиране | редактиране на кода]Златото е преходен метал в 6-и период, 11-а група и пореден номер 79. Електронната му структура е KLMN5s25p65d106s1.
Обичайните степени на окисление на златото са +1 и +3, по рядко +2 и +5. Съществуват и редки златни съединения със степен на окисление −1, наречени ауриди – напр. цезиев аурид (CsAu), меден аурид (Cu3Au). Златните йони в разтвор се редуцират и утаяват чрез добавяне на друг метал като редукционен агент. Добавеният метал се окислява и се разтваря, измествайки златото от разтвора и давайки му възможност да се отдели като твърда утайка. Златото с висока чистота няма вкус и мирис, което е свързано с неговата устойчивост на корозия: вкусът на металите се дължи на образуваните в разтвора метални йони.[17]
Свиването на 6s-орбиталите в златото определя по-голямото сродство на златните атоми към електрона и значително по-голяма електроотрицателност. Златото има най-голямо сродство на електрона и най-голяма електроотрицателност от всички метали.[8]
Вследствие на релативистичния ефект 5d-орбиталите се дестабилизират и електроните на тези орбитали лесно се отделят. Затова втората и третата йонизационна енергия на златото са ниски и сумата от трите му йонизационни енергии е най-ниската в групата.[8]
Няма данни за енергията на хидратация при различните степени на окисление на Au. Енергията на хидратация на малкия по размер и голям по заряд Au(III) е достатъчна за стабилизиране на третата степен на окисление на Au в разтвори.[8]
Енергията на атомизация при златото е най-голямата в групата поради по-здравите d-връзки в металната решетка вследствие по-доброто припокриване на 5d-орбиталите. За двуатомната молекула Au2(g) тя е 221 kJ/mol и е по-голяма от енергията на дисоциация на I2(g) (151kJ/mol) и малко по-малка от тази на Cl2(g) (243 kJ/mol).[8]
Златото не реагира химически с въздуха, влагата и повечето корозивни вещества, което го прави подходящо за използване в монети и украшения, а също и като защитно покритие на други, по-реактивни метали. Въпреки това златото не е напълно инертно химически. Не взаимодейства непосредствено с кислорода, водорода, азота, фосфора, антимона и въглерода. Изследванията показват, че само повърхностните атоми на златото взаимодействат с кислорода. То е неразтворимо в повечето течности, но се разтваря в смес от силни киселини – т. нар. царска вода. Не взаимодейства с чисти киселини и основи, освен в гореща селенова киселина:
В смеси с азотна или сярна киселина с манганова киселина (HMnO4), и в царска вода:
След изпарение се образуват жълти кристали на комплексното съединение водороден тетрахлороаурат хидрат . Във водни разтвори на цианиди (Na, Ca, K), при достъп на кислород или други окислители, златото се разтваря, образувайки цианоаурати:
Цианоауратите се редуцират до чисто злато:[7]
Тези две реакции лежат в основата на важния промишлен процес за извличане на златото от рудите.
Освен това на златото действат и разтопени смеси на основи и нитрати на алкалните метали, а също и други съединения като халогени и други неметали:
Взаимодейства с някои оксиди, киселини и соли при по-специфични условия:[7]
Съединения
[редактиране | редактиране на кода]+1 степен на окисление
[редактиране | редактиране на кода]Златото в +1 степен на окисление е познато само като AuCl, AuBr и AuI, които имат жълт цвят и при нагряване се разпадат. Те се получават при контролирано термично разлагане на съответните трихалогениди. Простите неутрални халогениди (AuX) са полимери с мостови халогенидни лиганди. Комплексните йони [AuX2]− се диспропорционират във воден разтвор съгласно уравнението:
.[19]
Йоните [AuX2]− могат да се стабилизират в присъствието на излишък от халогенидни йони.
Познати са още комплексни цианидни соли – M[Au(CN)2], където M е алкален метал. Известна е и свободна цианозлатна киселина – H[Au(CN)2].
Златен полисулфиден анион [Au12S8]4− е получен чрез разтваряне на Au2S, Au2S3 или [AuCl4]− във воден разтвор на Na2S и е изолиран като Ph4As+ сол. Кубиноподобният анион има серни атоми в ъглите на куба и златни атоми в средата на всяка страна, като така един серен атом е свързан с 3 алатни атома, а един зланет – с два серни.[19]
Представляват интерес клъстерните комплекси на Au(I) с алкилсулфиди – (AuSR)n, където R е алкилов радикал, а n≤11.[8] Тези комплекси са много разтворими в органични разтворители и поради голямото съдържание на злато в тях се наричат течно злато.[8] Използват се за украсяване на порцеланови и стъклени съединения.
+3 степен на окисление
[редактиране | редактиране на кода]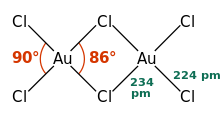
Всички известни съединения на Au(III) са диамагнитни и повечето от тях имат плоскоквадратна геометрия.[19]
От бинерните съединения на Au(III) са получени халогениди, оксид и хидроксид. Златният трихлорид AuCl3 и AuBr3 се получават при директна синтеза при 200 °C. Те имат червен и червено-кафяв цвят, респективно, и при загряване се разпадат най-напред на AuCl и AuBr, а след това до елементарната форма на златото. Молекулите им имат планарна триизмерна структура в газообразно и твърдо състояние.[8] При загряване с флуор или BrF3 от тях се получава оранжево-жълтият AuF3, които е най-стабилен. AuI3 не е синтезиран.[8] Всички златни трихалогениди са разтворими във вода.
Изходната златна сол, от която се получават други златни съединения е AuCl3, чийто разтвор се получава при взаимодействие на Au с царска вода. При излишък на HCl се получава планарният комплекс [AuCl4]−, а с I− се получава AuI и I2. Известни са много други Au(III) комплекси от вида [AuX4]−, X = F, Br, CN, SCN, NO-
3 и др. Тяхната стабилност е в реда [AuF4]− > [AuCl4]− > [AuBr4]− > [AuI4]−. Йонът [AuI4]− е настабилен и ласно се разлага до [AuI2]−.[19]
При алкализиране на разтвор на AuCl3 пада кафява утайка от хидратирания оксид – Au2O3•nH2O. Той се разлага над 160 °C на злато и кислород. Хидратният Au2O3 има амфотерен характер, но по-силно са застъпени киселинните свойства. Известна е солта калиев метааурат – KAuO2•3H2O.[8]
При нагряване на разтвор на AuCl3 с концентрирана HCl кристализира хлорозлатна киселина – ауро(III)-хлороводородна киселина,[8] H[AuCl4]•3H2O. Познати са различни нейни соли. Натриевият тетрахлороаурат Na[AuCl4]•2H2O има жълт цвят и е известен като златна сол.
Комплексите на злато(III) с азотен донорен атом обикновено са образуват от изместването на хлориден йон в H[AuCl4] от азот-донорни лиганди.
Познати са комплекси на Au(III) с органични лиганди. Аминокомплексите на Au(III) са киселинни. Отслабването на N–H връзките в аминните комплекси от Au(III) се дължи на високаото поляризиращо действие на Au(III).[19]
Други степени на окисление
[редактиране | редактиране на кода]
Освен +1 и +3 степен на окисление, златото проявява по-рядко и други степени на окисление.
Съществуват златни съединения със степен на окисление −1, наречени ауриди. Известни са няколко ауриди на алкални метали M+Au− (M = Na, K, Rb & Cs), меден аурид (Cu3Au) и бариев аурид (BaAu2).[19] Аналогични съединения не се наблюдават при Cu и Ag. Тези съединения не са метални сплави, имат червен цвят, кристализират в тип CsCl и са полупроводници.[8] Бариевият аурид кристализира в тип AlB2.[19]
В газово състояние златото съществува под формата на Au2 молекули. Най-простият комплекс с тази молекула е [Ph3PAuAuPPh3] (Ph е фенилова група).[19]
Много комплекси, които изглеждат като Au(II) въз основа на техните емпирични формули, са всъщност комплекси със смесени степени на окисление Au(I)–Au(III). Използва се електронна спектроскопия за разграничаване на тези комплекси със смесено окислително състояние от истинските комплекси на Au(II).[19]
Съединенията на злато(II) без Au–Au връзки обикновено се получават чрез редукция на Au(III). Има няколко двуядрени златни(II) комплекси с Au–Au връзки. Те се получават от съответните комплекси на злато(I) чрез окислителни присъединителни реакции. В специален случай се изолират Au(II)–Au(II) и Au(I)···Au(III) изомерни продукти. Няколко двуядрени комплекса могат да се свързват, за да образуват линейни комплекси Au9+
5 и Au10+
6. Те са Au(I)–Au(III) съединения.[19]
Съединенията на Au(IV) са редки. Единственият мономер е [Au(bdt)2] (bdt е бензо[1,2-b:4,5-b′]дитиофен).
Известни са само флуоридни съединения на Au(V). Всички те са октаедрични, тъй като Au(V) е d6 метален йон.[19]
Освен тетрахалогенидните комплекси е познат и хексафлуориден комплекс [AuF6]−. Той се получава от златния пентафлуорид AuF5, който се синтезира с помощта на KrF2. Може да бъде получен и по реакцията:
.[8]
Златният пентафлуорид е силно флуориращ агент. Разлага се на AuF3 и F2. С алкални флуориди дава комплексни съединения – флуороаурати. С флуороводород се образува ауро(V)-флуороводородна киселина H[AuF6], която кристализира при 88 °C.[8]
Златни клъстери
[редактиране | редактиране на кода]Златни клъстери, съдържащи от 2 до 13 златни атома са характеризирани с рентгенова кристалография. Това е единственият точен метод за структурна характеристика на златни клъстери.[19] В тях средната степен на окисление на един златен атом е по-малка от 1. Тези съединения са често синтезирани от [Au(PR3)X] (X = халогенид, NO−
3 и др.) с редуциращи агенти като NaBH4, CO, H2, B2H6 или Ti(C6H5CH3)2.[19]
Същеструват и хетероядрени клъстери, съдържащи поне една връзка Au–М (М е метал). Реагенти като R3P–Au–X или [(R3P–Au)3O]+ са често използвани за включване на метали атоми в златни клъстери. Те са разнообразни съединения – Au18Ag19, [(Ph3P)10Au13Ag12Br8]+, [Pt(AuPPh3)8(Hg)2]4+ и др.[19]
Съществуват много необикновени Au(I) съединения, чиито структури са силно повлияни от вторични Au···Au свързвания. Au–Au взаимодействията са отговорни са необичайната стереометрия на тези съединения.[19]
Много златни съединения с благородни газове от вида Ar–Au–Cl, Kr–Au–Cl, и Xe–Au–Cl са доказани чрез микровълнова и масова спектроскопия.
Получаване
[редактиране | редактиране на кода]Златото се среща рядко в чист вид, но лесно могат да бъдат изолирани негови съединения с други елементи.
То може да се получи от златоносните пясъци по два метода – живачен и цианиден.[8]
При живачният метод пясъците се обработват с живак, образуващ амалгама със златото. След това живакът се отдестилира. Течните живачни отпадъци обаче тровят реките и хранителните вериги, а при вдишване носят риск за здравето.
При цианидния метод златото се извлича от златоносния пясък или стрити бедни на Au руди[8] при обработка с разтвори на натриева основа или 0,1 – 0,2 % разтвор на натриев цианид в присъствие на кислород:
.
По-нататък разтворът на комплексната цианидна сол на златото се обработва с цинков прах:
.
Пречистването на златото става чрез електролиза, при което се получава злато с чистота 99,95 %.[8]
Цианидният метод може да се използва и за получаване на сребро.[8]
Добив на злато
[редактиране | редактиране на кода]Известна е обработката на злато още от петото хилядолетие преди новата ера. За цялата история на развитие на човешката цивилизация са добити около 161 хиляди тона (по оценка от 2011 г.).[20]
През 2007 г. в света са добити 2,38 хил. тона злато, а през 2008 – 2,33 хил. тона.
| Място | Страна | Добив 2006 (t) | Добив 2007 (t) | Добив 2008 (t) | Добив 2009 (t) | Добив 2010 (t) | Добив 2011 (t) | Добив 2012 (t) | Добив 2013 (t) |
|---|---|---|---|---|---|---|---|---|---|
| 1 | 245 | 275 | 295 | 320 | 345 | 362 | 403 | 420 | |
| 2 | 272 | 252 | 250 | 198 | 189 | 181 | 160 | 145 | |
| 3 | 252 | 238 | 230 | 223 | 231 | 234 | 235 | 227 | |
| 4 | 244 | 246 | 225 | 222 | 261 | 258 | 250 | 255 | |
| 5 | 203 | 170 | 175 | 182 | 164 | 164 | 161 | 150 | |
| 6 | 159 | 157 | 165 | 191 | 192 | 200 | 218 | 220 | |
| 7 | 104 | 101 | 100 | 97 | 91 | 97 | 104 | 120 | |
| 8 | 164 | 118 | 90 | 130 | 120 | 96 | 59 | 60 | |
| 9 | 85 | 85 | 90 | 90 | 91 | 93 | 93 | ||
| 10 | 84 | 84 | 86 | 82 | 80 | 87 | 85 | ||
| 11 | 65 | 65 | 66 | 68 | 66 | 53 | 62 | ||
| 12 | 42 | 42 | 41 | 38 | 45 | 50 | 55 | ||
| 13 | 39 | 41 | 51 | 73 | 84 | 97 | 100 | ||
| 14 | 40 | 40 | 60 | 58 | 62 | 65 | 75 | ||
| други страни | 818 | 471 | 446 | 490 | 559 | 640 | 655 | 700 | |
| Общо тона годишен добив | 2460 | 2383 | 2264 | 2447 | 2561 | 2660 | 2690 | 2767 | |
| Цена млн. долара за тон | 16.5 | 20.3 | 26.8 | 28 | 35 | 45.2 | 51.4 | 53.3 | |
| Общо милиарда долара | 40.59 | 48.375 | 60.675 | 68.516 | 89.635 | 120.232 | 138.266 | 147.481 |
В България добивът на злато за 2018 година е 8,995 тона, главно от находището в Челопеч.[22] Според геолога Вълко Гергелчев, златните запаси на страната са към 700 – 800 тона, а златните прогнозни ресурси са към 20 000 тона.[23]
Най-големите държавни златни запаси в света
[редактиране | редактиране на кода]В долната таблица са показани само държавните златни запаси (и златният запас на МВФ). Трябва да се отчете, че в много страни частни лица притежават значително по-голям по обем злато в сравнение със златния запас на съответните държави. Например, през декември 2011 г. частното злато в Индия е 18 000 тона,[24] като държавният златен запас през 2013 г. е 557,7 тона.[25]
| № | Страна/Организация | Злато (тона) |
Процентът на златото в общият обем на държавния валутен резерв (%) |
|---|---|---|---|
| 1 | 8133,5 | 75,3 % | |
| 2 | 3381 | 69 % | |
| 3 | Международен валутен фонд | 2814 | — |
| 4 | 2451,8 | 68,3 % | |
| 5 | 2435,6 | 63,2 % | |
| 6 | 1788,4 | 2,2 % | |
| 7 | 1447 | 15,1 % | |
| 8 | 1040 | 6,8 % | |
| 9 | 765,2 | 2,4 % | |
| 10 | 612,5 | 59,4 % |
След въвеждането на валутния борд Българска народна банка поддържа около 40 тона златен резерв,[27] 40,8 тона към юли 2020 година според интернационалните финансови статистки на Международния валутен фонд.[28]
Приложения
[редактиране | редактиране на кода]Историческо приложение
[редактиране | редактиране на кода]Златото е известно на човечеството от IV хил.пр.Н.е.[7] Намирано е било в пясъчните наноси на реките във вид на безформени зърна и люспи и е използвано за украшения. Най-ранните идентифицирани данни за използването на златото са от Египет и Месопотамия, но най-старото обработено злато е от Варна. През III хил. пр.н.е. излети златни съдове се използват за обмен на товари. Тогава Египет е център на преработката на злато и неговото пречистване, като механична обработка е отразена в стенни релефи от 2300 г. пр.н.е.[7] Набавянето на злато става чрез събиране на самородно злато при отделянето му от речните пясъци чрез използването на по-високата му плътност от пясъка.
С колонизирането на Централна Америка през XVI век, започва добиването на злато в Новия свят, където то е изчиствано и превозвано в Европа.[7] През първата половина на XVIII век големи залежи са открити в Бразилия и Русия.[7]
Паричен обмен
[редактиране | редактиране на кода]
Още от древността златото се използва в много части на света като парично средство за размяна във вид на монети или в друга форма. Тъй като чистото злато е твърде меко за употреба в ежедневния паричен обмен, златните монети обикновено се секат от сплави с примеси на мед, сребро или други метали, които им придават по-голяма твърдост. Така например английските златни монети, в обращение от 1526 г. до 30-те години на XX век, са с чистота 22 карата (91,6 %),[29] а американските след 1837 г. – със златно съдържание 90,0 % (21,6 карата).[30]
Първите златни монети през Античността се секат в Лидия около 700 г. пр.н.е.[31] Древногръцкият златен талант е с маса между 8,42 и 8,75 g.[32] Други известни исторически златни монети са например ауреусът, солидът, номизмата, перперата, дукатът, курушът, османската лира. След продължителен период на използване на предимно сребърни монети, европейските икономики подновяват масовото сечене на златни монети през XIII – XIV век.[33] През XIX век златото започва да се използва широко като обезпечение на банкноти чрез системата на златния стандарт.
Рязкото нарастване на държавните разходи по време на Първата световна война кара повечето държави, участващи в нея, да финансират дефицитите си за сметка на увеличаване на паричната маса и обезценяване на парите, отказвайки се на практика от златния стандарт. След войната някои страни правят опити да се върнат към него, но след Втората световна война почти всички държави изоставят тази система за сметка на фиатните пари. Последната държава, прибягнала до тази мярка, е Швейцария, която се отказва от задължителното обезпечение на парите със злато през 2000 г.[34]
Инвестиция
[редактиране | редактиране на кода]
Дори след премахването на златния стандарт златото запазва част от монетарните си свойства и някои инвеститори го използват като запас от стойност, като влагат средствата си обикновено в инвестиционни монети или златни кюлчета. Това обикновено се прави като защита срещу инфлация/хиперинфлация или други икономически сривове. Някои икономисти подлагат на съмнение ефективността на такива вложения.[35]
Тъй като не са предназначени за ежедневна употреба, изискванията към механичните свойства на инвестиционните монети са по-ниски и те обикновено се изготвят с чистота 24 карата (минимум 99,9 %, най-често 99,99 %), макар че има и изключения. Например, американският златен орел, британският суверен и южноафриканският крюгерранд и днес по традиция използват чистота 22 карата (т. нар. crown gold).[36] Инвестиционната монета с най-голяма чистота на златото е канадският златен кленов лист, в който златото е 99,999 %.
Частните инвеститори често използват кюлчета злато с маса 1 kg и форма, близка до правоъгълен паралелепипед. На световния пазар на злато се търгуват предимно т.нар. „стандартни кюлчета“ с тегло 400 унции/12,4 kg, използвани напр. от централните банки като златен резерв.
Бижутерия
[редактиране | редактиране на кода]
Златото намира широко приложение в бижутерията. Чистото злато е неподходящо за изработка на украшения, бижута и пр., тъй като е твърде меко и лесно се надрасква и деформира. Затова в бижутерията обикновено се използват различни златни сплави с чистота 22, 18, 14 или 10 карата, като по този начин се изменят неговата твърдост и дуктилност, температура на топене, цвят и други свойства. Най-често използваният допълнителен метал в тези сплави е медта.[11]
18-каратовото злато, съдържащо 25 % мед, често използвано в античната и руската бижутерия, има червеникав цвят и е известно като „червено злато“, „руско злато“ или „турско злато“. Аналогичните сплави с добавка и на сребро се наричат „розѐ“. 14-каратовата златно-медна сплав има цвят, почти еднакъв с този на някои бронзови сплави. Синкав цвят може да се получи чрез добавяне на желязо, а лилав – на алуминий, но тези разновидности се използват много рядко, поради по-трудната им обработка.[11]
14- и 18-каратовата сплав със сребро има зеленикаво-жълт цвят. Бялото злато се получава чрез добавяне на паладий или никел, а 18-каратовото злато, съдържащо 17,3 % никел, 5,5 % цинк и 2,2 % мед е сребристо на цвят. От друга страна никелът е токсичен и отделянето му от бялото злато е регулирано в някои страни.[11] Бялото злато, съдържащо паладий, е по-скъпо от съдържащото никел. Висококаратните сплави на бяло злато са много по-устойчиви на корозия от среброто и стърлинга.
В България и региона за изработка на бижута най-често се използва 14-каратово злато. В някои държави се използват сплави с по-високо съдържание на злато, а в далечния изток се предпочита почти чистото злато (напр. тайландско злато). В някои страни сплави с по-малко от 50 % злато (по-малко от 12 карата) не е разрешено да се наричат „златни/злато“ и да се продават като такива.
Медицина
[редактиране | редактиране на кода]
Според някои изследователи златото е най-старото използвано лекарство.[37] То е известно още на Педаний Диоскурид.[38][39] В същото време токсикологията му не е изцяло изучена.[40]
Преди появата на научната медицина златото е смятано за полезно за здравето поради своята рядкост и красота. Дори някои съвременни езотерични течения и форми на алтернативната медицина приписват на златото лечебни свойства.[41] Някои соли и радиоизотопи на златото действително имат противовъзпалително действие и се използват при артрит и други подобни състояния,[42] както и за лекуване на рак, но като чист метал златото е напълно инертно към химическите вещества в човешкото тяло.
Сплави на златото се използват във възстановителната стоматология за изготвяне на корони и мостове. Ковкостта на златните сплави позволява по-прецизно възстановяване на повърхността на зъба, отколкото при порцелановите корони. Използването на златни корони при видими зъби, като резците, се насърчава при някои култури и се смята за нежелателно при други.
Различни форми на златото намират приложение в някои изследователски методи, използвани в медицината и биологията. Колоидното злато представлява суспензия на златни наночастици, които имат свойството да абсорбират протеинови молекули по своята повърхност. Такива частици, покрити с определени антитела, могат да се използват за откриване на дадени антигени по повърхността на клетките.[43][44]
Златото и негови сплави с паладий се използват като електропроводящо покритие на биологични проби и други непроводящи материали, като пластмаси и стъкло, за да бъдат наблюдавани със сканиращ електронен микроскоп. Покритието, което обикновено се нанася чрез магнетронно разпрашване с аргонова плазма, изпълнява три функции. Много високата електропроводимост на златото отвежда електрическите заряди от пробата, а високата му плътност спира проникването на електроните, ограничавайки дълбочината, до която електронният лъч прониква в образеца. Това подобрява определянето на положението и топографията на повърхността на образеца и увеличава пространствената разделителна способност на изображението. В същото време от златото се отделят голямо количество вторично емитирани електрони, които имат ниска енергия и са най-често използваният източник на сигнал в сканиращите електронни микроскопи.[45]
Чистото злато не е токсично и не е биологичен дразнител при поглъщане.[7] Златни соли като AuCl3 са токсични и увреждат черния дроб и бъбреците.
Златни соли в дозирано количество се използват в медицината като антивъзпалителни лекарства при ревматични артрити. Съедининеята на златото се прилагат за лечение на туберкулоза и труднолечими кожни заболявания. Чистото злато, подобно на среброто, притежава антибактериални свойства.[7]
Хранителна добавка
[редактиране | редактиране на кода]Златото е регистрирано като хранителна добавка с код Е175.[46] Златно фолио, люспи или прах се използва в някои специални храни, главно в десерти и напитки, като декоративна съставка.[47] Голдвасер („златна вода“) е традиционен билков ликьор, приготвян в Гданск и Швабах, който съдържа частици златно фолио.
В чист вид златото е напълно инертно към химичните вещества в човешкия организъм, не променя вкуса на храните и няма хранителна стойност.[48]
Електротехника
[редактиране | редактиране на кода]Златото е незаменимо като материал за електрически контакти. От една страна то има много висока електропроводимост, което намалява загубите. От друга страна не корозира и предпазва от корозия, поради това намалява контактното съпротивление, предпазва от залепване на контактите и др. В космическата техника и микроелектрониката проводниците често са златни, а контактни повърхности, съединители, печатни платки и т.н. често се покриват галванично със злато.

Други области на техниката
[редактиране | редактиране на кода]Любопитни факти
[редактиране | редактиране на кода]- Сходството между златото и минерала пирит е станало причина пиритът да бъде наречен „златото на глупака“. Разликата между златото и пирита се установява при силен удар с остър предмет. Пиритът ще се надроби, а по златото ще остане дълбока следа от острието.
- Златото има плътност около 19,3 t/m3, много по-висока от тази на повечето метали. Затова фалшификатите могат да се отличат лесно чрез претегляне: При еднакви размери фалшификатът е по-лек. За фалшифициране на изделия от чисто злато може да се използва волфрам, който има почти същата плътност – 19,25 t/m3. Фалшификати на базата на волфрам не могат да се отличат чрез претегляне, затова е необходимо да се използват други методи, които се базират например на електропроводимостта, скоростта на звука или измерване на магнитните свойства.
- Предполага се, че в земното ядро се съдържат значителни количества тежки метали, вкл. и злато.
- Съдържанието на злато в доста съвременни находища е много ниско – няколко грама на тон скална маса. Това оскъпява значително добива на метала.
Вижте също
[редактиране | редактиране на кода]
Бележки
[редактиране | редактиране на кода]- ↑ Lide 2005.
- ↑ Kelly 2015.
- ↑ World Gold Council 2012.
- ↑ Soos 2011.
- ↑ а б Георгиев 1971, с. 644 – 645.
- ↑ Hesse 2007.
- ↑ а б в г д е ж з и к л м н Лефтеров, Димитър. Химичните елементи и техните изотопи. София, Академично издателство „Проф. Марин Дринов“, 2015. ISBN 978-954-322-831-7. с. 78 – 82.
- ↑ а б в г д е ж з и к л м н о п р с т у ф х Киркова, Елена. Химия на елементите и техните съединения. София, Университетско издателство „Св. Климент Охриски“, 2013. ISBN 978-954-07-3504-7. с. 589 – 602.
- ↑ webexhibits.org 2009.
- ↑ Mallan 1971, с. 216.
- ↑ а б в г Utilisegold.com 2000a.
- ↑ Math.ucr.edu 2009.
- ↑ Schmidbaur 2005, с. 151 – 161.
- ↑ Utilisegold.com 2000b.
- ↑ National Nuclear Data Center 2012.
- ↑ а б Audi 2003, с. 3 – 128.
- ↑ Pelouze 1854, с. 280.
- ↑ Gold: Chemical reactions // pilgaardelements.com. Посетен на 29 октомври 2020.
- ↑ а б в г д е ж з и к л м н о п King, R. Encyclopedia of Inorganic Chemistry (10 Volumes). Wiley, 2005. ISBN 9780470860786. с. 1448 – 1473.
- ↑ За свою историю человечество добыло 161 тысячу тонн золота – National Geographic Россия, архив на оригинала от 26 май 2012, https://web.archive.org/web/20120526154214/http://www.nat-geo.ru/article/236, посетен на 27 декември 2014
- ↑ Mineral commodity summaries 2009
- ↑ www.24chasa.bg
- ↑ Интервю с Професор Вълко Гергелчев[неработеща препратка]
- ↑ Обзор на пазарите за злато в Индия и Китай
- ↑ Reserve asset statistics // Архивиран от оригинала на 2013-12-15. Посетен на 2016-09-23.
- ↑ Statistics | World Gold Council
- ↑ www.gold.org
- ↑ Интернационални финансови статистки на МФВ", International Financial Statistics by IMF
- ↑ Lawrence 1948, с. 103.
- ↑ Tucker 1839, с. 393.
- ↑ Friedberg 2009.
- ↑ Seltman 1924.
- ↑ Postan 1967.
- ↑ The New York Times 1999.
- ↑ Feldstein 2009.
- ↑ americansilvereagletoday.com 2010.
- ↑ Kean 2008, с. 112 – 125.
- ↑ Moir 1831, с. 225.
- ↑ Mortier 2006.
- ↑ Merchant 1998, с. 49 – 59.
- ↑ ninemsn 2007.
- ↑ Messori 2004, с. 280 – 301.
- ↑ Faulk 1971, с. 1081 – 1083.
- ↑ Roth 1980, с. 55 – 57.
- ↑ Bozzola 1999, с. 65.
- ↑ Food Standards Agency 2010.
- ↑ Barron's Educational Services 1995.
- ↑ Geology.com 2010.
- Цитирани източници
- Бончев, Георги. Минералите в България // Годишник на Софийския университет, Физико-математически факултет 19 (1). 1923. с. 15 – 16. Посетен на 2 май 2024.
- Георгиев, Вл. И. (ред.). Български етимологичен речник. Том I. А-З. София, Издателство на Българската академия на науките, 1971.
- Костов, Иван. Минералогия. 3. София, Издателство „Наука и изкуство“, 1973. OCLC 859838412. с. 117 – 121.
- Костов, Иван; Бресковска, В.; Минчева-Стефанова, Й.; Киров, Г. Н. Минералите в България. София, Издателство на Българската академия на науките, 1964. OCLC 947184787. с. 76 - 78.
- Костов-Китин, Владислав. Злато Gold // Енциклопедия: Минералите в България. София, Издателство на БАН „Проф. Марин Дринов“, 2023. ISBN 978-619-245-365-7. с. 259- 261.
- The Ever Popular Krugerrand // americansilvereagletoday.com. americansilvereagletoday.com, 2010. Архивиран от оригинала на 2011-02-03. Посетен на 30 август 2011. (на английски)
- Audi, G et al. The NUBASE Evaluation of Nuclear and Decay Properties // Nuclear Physics A 729. Atomic Mass Data Center, 2003. DOI:10.1016/j.nuclphysa.2003.11.001. p. 3 – 128. (на английски)
- The Food Dictionary: Varak // Barron's Educational Services, 1995. Архивиран от оригинала на 2006-05-23. Посетен на 27 май 2007. (на английски)
- Bozzola, John J. et al. Electron microscopy: principles and techniques for biologists. Jones & Bartlett Learning, 1999. ISBN 0-7637-0192-0. (на английски)
- Faulk, WP et al. An immunocolloid method for the electron microscope // Immunochemistry 8 (11). 1971. (на английски)
- Feldstein, Martin. Is Gold a Good Hedge? // Project Syndicate, 26 декември 2009. Посетен на 29 декември 2009. (на английски)
- Current EU approved additives and their E Numbers // Food Standards Agency, 2010. Посетен на 4 юни 2010. (на английски)
- Friedberg, A L et al. Gold Coins of the World: From Ancient Times to the Present: an Illustrated Standard Catalog With Valuations. Coin & Currency Institute, 30 юли 2009. ISBN 0871843080. (на английски)
- The Many Uses of Gold // Geology.com, 2010. Посетен на 4 юни 2010. (на английски)
- Hesse, R W. Jewelrymaking Through History: An Encyclopedia. Greenwood Publishing Group, 2007. ISBN 0313335079. (на английски)
- Kean, W. F. et al. Clinical pharmacology of gold // Inflammopharmacology 16 (3). 2008. DOI:10.1007/s10787-007-0021-x. p. 112 – 25. (на английски)
- Lawrence, Thomas Edward. The Mint: A Day-book of the R.A.F. Depot Between August and December 1922, with Later Notes. 1948. (на английски)
- Mallan, Lloyd. Suiting up for space: the evolution of the space suit. John Day Co, 1971. ISBN 978-0-381-98150-1. (на английски)
- Relativity in Chemistry // Math.ucr.edu, 2009. Посетен на 5 април 2009. (на английски)
- Merchant, B. Gold, the Noble Metal and the Paradoxes of its Toxicology // Biologicals 26 (1). 1998. DOI:10.1006/biol.1997.0123. p. 49 – 59. (на английски)
- Messori, L. Gold Complexes in the treatment of Rheumatoid Arthritis // Metal ions and their complexes in medication. CRC Press, 2004. ISBN 9780824753511. (на английски)
- Moir, David Macbeth. Outlines of the ancient history of medicine. 1831. (на английски)
- Mortier, Tom. An experimental study on the preparation of gold nanoparticles and their properties // kuleuven.be. University of Leuven, 2006. Посетен на 16 октомври 2013. (на английски)
- Nudat 2 // National Nuclear Data Center, 2012. Посетен на 12 април 2012. (на английски)
- The healing power of precious metals // ninemsn, 2007. Посетен на 6 юни 2010. (на английски)
- Pelouze, Jules et al. General notions of chemistry. Lippincott, Grambo & Co, 1854. p. 280. (на английски)
- Postan, M M et al. The Cambridge Economic History of Europe: Trade and industry in the Middle Ages. Cambridge University Press, 1967. ISBN 0521087090. (на английски)
- Roth, J. et al. FITC-protein A-gold complex for light and electron microscopic immunocytochemistry // The journal of histochemistry and cytochemistry: official journal of the Histochemistry Society 28 (1). 1980. DOI:10.1177/28.1.6153194. p. 55 – 57. Архивиран от оригинала на 2020-03-25. Посетен на 2013-10-16. (на английски)
- Schmidbaur, Hubert et al. Understanding gold chemistry through relativity // Chemical Physics 311 (1 – 2). 2005. DOI:10.1016/j.chemphys.2004.09.023. p. 151 – 161. (на английски)
- Seltman, C T. Athens, Its History and Coinage Before the Persian Invasion. 1924. ISBN 0871843080. Посетен на 4 юни 2012. (на английски)
- Soos, Andy. Gold Mining Boom Increasing Mercury Pollution Risk // Oilprice.com. Advanced Media Solutions, 6 януари 2011. Посетен на 26 март 2011. (на английски)
- Swiss Narrowly Vote to Drop Gold Standard // nytimes.com. The New York Times, 19 април 1999. Посетен на 15 октомври 2013. (на английски)
- Tucker, George. The theory of money and banks investigated. 1839. (на английски)
- Gold: causes of color // webexhibits.org. webexhibits.org, 2009. Посетен на 6 юни 2009. (на английски)
- Gold Jewellery Alloys > Utilise Gold. Scientific, industrial and medical applications, products, suppliers from the World Gold Council // Utilisegold.com. Utilisegold.com, 20 януари 2000. Архивиран от оригинала на 2008-06-19. Посетен на 5 април 2009. (на английски)
- Gold Jewellery Alloys > Utilise Gold. Scientific, industrial and medical applications, products, suppliers from the World Gold Council // Utilisegold.com, 20 януари 2000. Архивиран от оригинала на 2008-06-19. Посетен на 5 април 2009. (на английски)
- FAQs // gold.org. World Gold Council, 2012. Архивиран от оригинала на 2012-01-01. Посетен на 17 ноември 2012. (на английски)
- Lide, D. R. Magnetic susceptibility of the elements and inorganic compounds // CRC Handbook of Chemistry and Physics. 86th. Boca Raton (FL), CRC Press, 2005. ISBN 0-8493-0486-5. (на английски)
- Kelly, P.F. Properties of Materials. CRC Press, 2015. ISBN 978-1-4822-0624-1. p. 355. (на английски)
Периодична система на елементите
| |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | ||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||||||||
| |||||||||||||||||||||||||||||||||||||||||





![{\displaystyle {\ce {[HAuCl4*3H2O]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/55d5279920d9a5996a60bb2fce5caf634d426b96)

![{\displaystyle {\ce {2K[Au(CN)2] + Zn -> K2[Zn(CN)4] + 2Au}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bb7d8b8ce51baf57fb83e94c4329375a5414ad0e)





![{\displaystyle {\ce {2H2O + 3 Cl2 + 2 Au -> 2 H[AuCl3(OH)]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b980d978aaf17e464cd0a1bcc7d8a7f62428dcd1)


![{\displaystyle {\ce {8HCl + 3 H2O2 + 2 Au -> 6 H2O + 2 H[AuCl4]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7010579e929c20dbdb4b25a98ad8d0e8e1c57f01)
![{\displaystyle {\ce {2Au + 7KrF2->5Kr + 2[KrF][AuF6]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4a75412a1c87a2b14050754ea64041c38325bc6f)
![{\displaystyle {\ce {3[Au^{I}X_2] -> [Au^{III}X_4] + 2Au + 2X^-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5dd196cfeef50181fce032c2fd11de46e738c68a)
![{\displaystyle {\ce {Au}}\mathrm {\xrightarrow[{\Delta T,~\Delta p}]{F_{2},~O_{2}}} {\ce {O2[AuF6]}}\mathrm {\xrightarrow {\Delta T} } {\ce {AuF5}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/67060ab5ef2cc2d82beb542e84f63a8cc06fa987)
![{\textstyle {\ce {4Au + 8NaCN +2H2O + O2 -> 4Na[Au(CN)2] + 4NaOH}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/56c2cc10b6ddf5db21f714342c8467c670256358)
![{\displaystyle {\ce {2Na[Au(CN)2] + Zn -> Na_2[Zn(CN)4] + 2Au}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/822e2cab79121fdc272f8ac4039c21aa728c7e99)