Неон
- Вижте пояснителната страница за други значения на Неон.
| Неон | |||||||||||||||||||||
 Безцветен газ, излъчващ оранжево-червена светлина при поставяне в силно електрическо поле | |||||||||||||||||||||
| |||||||||||||||||||||
| Общи данни | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Име, символ, Z | Неон, Ne, 10 | ||||||||||||||||||||
| Група, период, блок | 18, 2, p | ||||||||||||||||||||
| Химическа серия | благороден газ | ||||||||||||||||||||
| Електронна конфигурация | [He] 2s2 2p6 | ||||||||||||||||||||
| e- на енергийно ниво | 2, 8 | ||||||||||||||||||||
| CAS номер | 7440-01-9 | ||||||||||||||||||||
| Свойства на атома | |||||||||||||||||||||
| Атомна маса | 20,1797 u | ||||||||||||||||||||
| Атомен радиус (изч.) | 160 (38) pm | ||||||||||||||||||||
| Ковалентен радиус | 58 pm | ||||||||||||||||||||
| Радиус на ван дер Ваалс | 154 pm | ||||||||||||||||||||
| Степен на окисление | 0 | ||||||||||||||||||||
| Йонизационна енергия | I: 2080,7 kJ/mol II: 3952,3 kJ/mol III: 6122 kJ/mol (още) | ||||||||||||||||||||
| Физични свойства | |||||||||||||||||||||
| Агрегатно състояние | газ | ||||||||||||||||||||
| Кристална структура | кубична стенноцентрирана | ||||||||||||||||||||
| Плътност | 0,9002 kg/m3 | ||||||||||||||||||||
| Температура на топене | 24,56 K (−248,44 °C) | ||||||||||||||||||||
| Температура на кипене | 27,104 K (−245,896 °C) | ||||||||||||||||||||
| Тройна точка | 24,556 K; 4,337×104 Pa [1] | ||||||||||||||||||||
| Критична точка | 44,4918 K; 2,7686×106 Pa | ||||||||||||||||||||
| Специф. топлина на топене | 0,335 kJ/mol | ||||||||||||||||||||
| Специф. топлина на изпарение | 1,71 kJ/mol | ||||||||||||||||||||
| |||||||||||||||||||||
| Скорост на звука | 435 m/s при 0 °C | ||||||||||||||||||||
| Топлопроводимост | 0,0491 W/(m·K) | ||||||||||||||||||||
| Магнетизъм | диамагнитен | ||||||||||||||||||||
| Модул на свиваемост | 654 GPa | ||||||||||||||||||||
| История | |||||||||||||||||||||
| Наименуван | от гръцкото νέος – „нов“ | ||||||||||||||||||||
| Откритие | Уилям Рамзи и Морис Травърс[2][3] (1898 г.) | ||||||||||||||||||||
| Най-дълготрайни изотопи | |||||||||||||||||||||
| |||||||||||||||||||||
| Неон в Общомедия | |||||||||||||||||||||
Неонът (от гръцки: νέον, „нов“) е химичен елемент с атомен номер 10 и атомна маса 20,1797 u, означаван със символа Ne. Макар и често срещан във Вселената, той е сравнително рядък на Земята. При стандартни температура и налягане представлява инертен газ без цвят и мирис. При преминаване на електрически ток през тръба, пълна с неон, свети с червеникаво-оранжева светлина.[4][5] Произвежда се чрез извличане от въздуха, където присъства в много ниска концентрация.
История
[редактиране | редактиране на кода]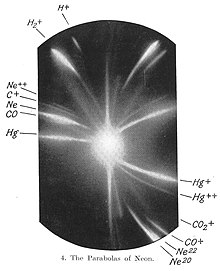
Неонът е открит през 1898 година от шотландеца Уилям Рамзи и англичанина Морис Травърс.[6] Това става, когато Рамзи охлажда проба от въздух до нейното втечняване, след което нагрява течността и улавя отделните газове при тяхното изпаряване. Така освен азот, кислород и аргон той изолира неизвестните до този момент инертни газове криптон, ксенон и неон.[7] за което през 1904 г. получава Нобелова награда за химия.[8]
Малките количества на неон във въздуха са пречка за бързото му прилагане за изработка на осветителни тела, подобно на лампите, напълнени с азот и получили разпространение в първите години на 20 век. След 1902 г. французинът Жорж Клод и неговата компания Air Liquid започва да произвежда промишлено неон като страничен продукт на основната си дейност по втечняване на въздух, а през декември 1910 г. Клод демонстрира и първата съвременна неонова лампа, използваща запоена тръба, пълна с неон. През 1912 г. сътрудник на Клод започва да продава неонови разрядни тръби, предназначени за рекламно осветление. С яркия си червен цвят те бързо печелят популярност, изпъквайки пред другите форми на светлинна реклама, съществуващи по това време.[9]
Неонът допринася за ранните изследвания на природата на атомите. През 1913 г. Джоузеф Джон Томсън, изучавайки състава на анодните лъчи (оказали се впоследствие снопове от йони), насочва потоци от неонови йони през магнитно и електрическо поле и измерва тяхното отклонение, поставяйки на пътя им фотографска плака. Той наблюдава две отделни следи светлина, които съответстват на две различни криви на отклоняване и стига до заключението, че някои от атомите на неоновия газ имат по-голяма маса от останалите. Макар че тогава Томсън не разбира напълно смисъла на наблюдението си, това е първото регистриране на изотопи на стабилни атоми в историята на науката.
Етимология
[редактиране | редактиране на кода]По разказа на Рамзи, името на новия газ е било подсказано от сина му, който бил впечатлен от червената спектрална линия и предложил да го нарекът „новиум“, но Рамзи предпочел името да бъде гръцкото νέον (neon), което означава „нов“.[8] По-късно Травърс пише: „Блясъкът на пурпурна светлина от тръбата беше красноречив и представляваше незабравима гледка“.[10]
Наличие в природата
[редактиране | редактиране на кода]Физични свойства
[редактиране | редактиране на кода]
Поставен в газоразрядна тръба, неонът дава плазма с червено-оранжев цвят. Освен това той има най-тесния диапазон на втечняване от всички химични елементи: от 24,55 K до 27,05 K (−248,45 °C до −245,95 °C, или −415,21 °F до −410,71 °F). Притежава 40 пъти по-голям капацитет за охлаждане от течния хелий и три пъти по-голям от течния водород (за единица обем).[11] В повечето приложения това е най-евтиният хладилен агент.[12]

Газовият разряд в неон образува плазма с най-интензивно светене от всички благородни газове при нормално напрежение и ток. Човешкото око възприема цвета като червено-оранжев поради множеството спектрални линии в тази област, но емисионният спектър на неона съдържа и ярка зелена атомна спектрална линия, която се вижда само със спектроскоп.[13]
Изотопи
[редактиране | редактиране на кода]Неонът е първият химичен елемент, за който е доказано, че се състои от няколко изотопа.[8] Съществуват три стабилни изотопа на неона: неон-20 (20Ne) (разпространение 90,48 %), неон-21 (21Ne) (0,27 %) и неон-22 (22Ne) (9,25 %).[14] Повсеместно преобладава лекият изотоп 20Ne.
В много минерали, проявяващи алфа радиоактивност, относителното съдържание на тежките изотопи 21Ne и 22Ne е десетки и стотици пъти по-голямо от съдържанието им във въздуха. Това се дължи на факта, че основни механизми за образуване на тези изотопи са ядрени реакции, протичащи при бомбардиране на ядрата на алуминия, натрия, магнезия и силиция с продукти от разпада на тежки елементи. Освен това подобни реакции протичат в земната кора и земната атмосфера под въздействието на космическите лъчи.
Наблюдават се и редица ядрени реакции с неголяма продуктивност,[15] при които се образуват 21Ne и 22Ne – това е захватът на алфа-частици от ядра на тежък кислород 18О и флуор 19F:
Източникът на лекия нуклид 20Ne, преобладаващ на Земята, не е установен.
Счита се, че в космическото пространство неонът също е преобладаващо представен от лекия нуклид 20Ne. В метеоритите се среща доста 21Ne и 22Ne, но се предполага, че те се образуват в самите метеорити под въздействието на космическите лъчи по време на пътешествието им из Вселената.
Освен трите стабилни изотопа на неона, съществуват и още шестнадесет нестабилни, чиито периоди на полуразпад са от няколко секунди до части от секундата.[8]
Химични свойства
[редактиране | редактиране на кода]Неонът е на второ място от благородните газове по атомна маса и има електронната структура 1s22s22p6. Според последните изследвания неонът е най-слабо реактивният от благородните газове и следователно – най-слабо реактивният химичен елемент.[16]
Приложение
[редактиране | редактиране на кода]Използва се за луминесцентни лампи. Най-популярното му приложение е за изработване на неонови реклами. Стъклени тръби с различен диаметър се огъват по шаблон, поставят се електроди, изпомпва се въздуха от вътре, загрява се тръбата посредством високо напрежение 20 000 волта и след охлаждане се вкарва газ неон. Ако се напълни тръбата със смес от неон и аргон, е необходимо да се добави живак и тогава тръбата свети в бледо синьо. Увеличаване на силата на светене става с помощта на луминофор. Боядисаната отвътре с цветен луминофор тръба дава възможност на тръбата да свети в различен цвят.
Участва в работната смес на хелий-неоновия лазер.
Вижте също
[редактиране | редактиране на кода]Източници
[редактиране | редактиране на кода]- ↑ Preston-Thomas, H. The International Temperature Scale of 1990 (ITS-90) // Metrologia 27. 1990. DOI:10.1088/0026-1394/27/1/002. p. 3 – 10. (на английски)
- ↑ William Ramsay. On the Companions of Argon // Proceedings of the Royal Society of London 63 (1). 1898. DOI:10.1098/rspl.1898.0057. p. 437 – 440. (на английски)
- ↑ Neon: History // Softciências. Архивиран от оригинала на 2007-03-14. Посетен на 27 февруари 2007. (на английски)
- ↑ Coyle, Harold P. Project STAR: The Universe in Your Hands. Kendall Hunt, 2001. ISBN 9780787267636. p. 464. (на английски)
- ↑ Kohmoto, Kohtaro. Phosphors for lamps // Phosphor Handbook. CRC Press, 1999. ISBN 9780849375606. p. 940. (на английски)
- ↑ Ramsay, William et al. On the Companions of Argon // Proceedings of the Royal Society of London 63. 1898. DOI:10.1098/rspl.1898.0057. p. 437 – 440. (на английски)
- ↑ Neon: History // Softciências. Архивиран от оригинала на 2007-03-14. Посетен на 27 февруари 2007. (на английски)
- ↑ а б в г Лефтеров, Димитър. Химичните елементи и техните изотопи. София, Издателство на БАН „Проф. Марин Дринов“, 2015. ISBN 978-954-322-831-7. с. 356 – 359.
- ↑ Mangum, Aja. Neon: A Brief History // New York Magazine, 8 декември 2007. (на английски)
- ↑ Weeks, Mary Elvira. Discovery of the Elements: Third Edition (reprint). Kessinger Publishing, 2003. p. 287. (на английски)[неработеща препратка]
- ↑ ((en)) Hammond, C.R. (2000). The Elements, in Handbook of Chemistry and Physics 81st edition. CRC press. p. 19. ISBN 0-8493-0481-4. [1].
- ↑ NASSMC: News Bulletin // 30 декември 2005. Архивиран от оригинала на 2007-02-13. Посетен на 5 март 2007. (на английски)
- ↑ Plasma // Архивиран от оригинала на 2007-03-07. Посетен на 5 март 2007. (на английски)
- ↑ Isotopes of neon // www.webelements.com. Посетен на 2009-07-8. (на английски)
- ↑ ((ru)) Финкельштейн Д.Н. „Инертные газы“[неработеща препратка]. Москва, Наука 1979, стр. 83.
- ↑ Lewars, Errol G. Modelling Marvels. Springer, 17 ноември 2008. ISBN 1402069723. p. 70 – 71. (на английски)
Периодична система на елементите
| |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | ||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||||||||
| |||||||||||||||||||||||||||||||||||||||||



