Химично съединение
 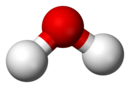 | |
| Чистата (без примеси) вода (H2O) е пример за химично съединение: моделът на молекулата показва пространствето разпределение на двете части водород (бяло) и едната част кислород (червено) | |
  | |
| Кристал на солта и структура | |
  | |
| Пирит и неговата структура | |
| Химично съединение в Общомедия |
Химичното съединение е сложно химично вещество, съставено от идентични молекули на атоми на два или повече химични елемента, свързани помежду си с химични връзки и имащи определени химични свойства. В химичното съединение връзката се осъществява посредством отдаването или приемането на електрони, броят на които зависи от валентността на елементите, които участват в химичната реакция.[1][2][3] Химичните съединения могат да бъдат молекулярни съединения с ковалентни връзки, соли с йонни връзки, интерметални съединения с метални връзки или по-сложни химични комплекси от координирани ковалентни връзки. Могат да бъдат разделени на по-прости вещества с помощта на химични реакции.[4]
Те имат строго определена и постоянна структура като атомите са в определена пропорция помежду си.[3] Когато атоми на два или повече химични елемента си взаимодействат и се свържат химично в определени тегловни съотношения, те образуват химично съединение. Така например атомите на сярата и желязото когато са нагрети, си взаимодействат и се получава ново вещество наречено железен сулфид.
Химичната формула определя броя на атомите на всеки елемент в съставната молекула, като се използват стандартните съкращения за химичните елементи и числов индекс. Например молекулата на водата има формула H2O, обозначаваща два водородни атома, свързани към един кислороден атом. Много химически съединения имат уникален идентификатор CAS номер, определен от Химическатареферативна служба на САЩ.
Съществува променлива и понякога непоследователна номенклатура за разграничаване на веществата, които включват наистина нестехиометрични примери за химични съединения и които изискват да се определят пропорциите. Много твърди вещества, например силикатните минерали, нямат прости формули, които отразяват химичното свързване на елементите един с друг във фиксирани пропорции. Въпреки това, тези кристални вещества често се наричат нестехиометрични съединения. Променливостта в съставите им често се дължи на наличието на чужди елементи, захванати в кристалната структура на истинското химично съединение или поради нарушения в структурата му, което възниква поради излишък или дефицит на съставните елементи на места. Такива нестехиометрични вещества съставляват по-голямата част от земната кора и земната мантия. Други химически съединения могат да имат различно количество тежки или леки изотопи на съставните елементи, което леко променя съотношението на масите на елементите.
Химични вещества, които са съставени от молекули с два или повече атома на един и същ елемент не се считат за химични съединения (например H2, S8).[5]
История[редактиране | редактиране на кода]
За формулирането на концепцията за химично съединение е важен законът за постоянния състав, открит от Жозеф Пруст през 1799 г.[6] Този закон гласи, че независимо как е получено определено съединение, то винаги се състои от едни и същи химични елементи и съотношението на масите на тези елементи се изразява в малки цели числа. Няколко години по-късно, през 1803 г. Джон Далтон формулира закона за кратните отношения, според който в случай, когато две съединения могат да се образуват от определени елементи, масата на първия се съчетава с масите на другите така, че тяхното отношение е цяло число.[7][8] Тези две твърдения подготвят пътя за разбиране на атомната структура на материята. Концепцията за химична структурна формула е въведена през 1850 г. от немския химик Фридрих Август Кекуле.
Важни характеристики[редактиране | редактиране на кода]
Химичните съединения имат няколко елементарни, но съществени характеристики. Химичните елементи в едно химично съединение съществуват в постоянна и определена пропорция. Така например 2 атома водород и един атом кислород формират една молекула вода.
Химичните съединения имат определен набор от физични и химични свойства. Отделните елементи, които съставят съединението, не запазват свойствата си. Например водородът и кислородът са газове, а в съотношение 2:1 образуват вода, която е течност със съвсем нови свойства и характеристики. Химичните елементи в дадено съединение не могат да бъдат разделени с помощта на физични средства.
Разлики между химични съединения и смеси[редактиране | редактиране на кода]
Една от най-важните разлики между химично съединение и смес е, че отделните компоненти, отделните съставки на сместа могат да се разделят с обикновени, механични и физични средства като филтриране, изпарение, употреба на магнит и т.н., докато компонентите на химичното съединение могат да бъдат отделени само с помощта на химични реакции.
Друга характеристика са физичните и химични свойства, така например свойствата на смесите зависят от свойствата на отделните съставки, докато химичните съединения имат физични и химични свойства напълно различни от съставящите ги елементи.
Въпреки това някои смеси са толкова еднородни, че лесно могат да бъдат объркани със смеси. Пример за това са сплавите. Те се получават механично със смесването на метали в течно състояние (след загряване) и след това охлаждането им до получаване на еднородна смес.
Химична формула[редактиране | редактиране на кода]
Химиците описват химичните съединения като използват различни формули. Когато химичните съединения са молекулни, се показва химичната формула за една молекулна единица. За полимери, минерали или метални оксиди се използва емпиричната формула като например NaCl за обикновената сол.
Елементите в химичната формула са записани обикновено в определен ред. Въглеродните атоми обикновено са първи, а водородните атоми следват веднага след това. Ако формулата не съдържа въглерод, другите химични елементи, включително водород, се записват в азбучен ред. Въпреки това има изключения от това правило. За йонните съединения положителният йон се записва пръв, а отрицателният на второ място. При оксидите, кислородът се записва последен. Органичните киселини обикновено следват това правило с C и H в началото на формулата, например C2HF3O2. Въпреки това формулите на неорганичните киселини обикновено са изключения от това правило. Те започват с водород. Формулата за основа завършва с хидроксилната група (OH-).
Тази статия се нуждае от вниманието на редактор с по-задълбочени познания. Ако смятате, че имате необходимите знания, подобрете тази страница. |
Видове химични съединения[редактиране | редактиране на кода]
Органични съединения[редактиране | редактиране на кода]


Органични съединения се наричат група от химични съединения, чиито молекули съдържат въглерод. По исторически причини, някои видове съединения, например карбонатите, простите оксиди на въглерода, цианидите и карбидите, както и алотропните форми на въглерода не се считат за органични, въпреки че съдържат въглерод. Основните класове са органичните химични съединения са липидите, нуклеиновите киселини, въглеводородите и белтъците.
Изключения[редактиране | редактиране на кода]
Карбонати[редактиране | редактиране на кода]
Карбонати са солите на въглеродната киселина, включващи в състава си карбонатен анион, CO2-
3. С карбонат може да се обозначават и естери на въглеродната киселина. Карбонатният йон е най-простият оксикарбонов анион. Състои се от един въглероден атом, заобиколен от три кислородни атома, в триъгълна равнинна подредба, с D3h молекулярна симетрия. Той има молекулна маса 60,01 g/mol и носи заряд от -2.
Карбиди[редактиране | редактиране на кода]
Карбид се наричат съединенията на въглерода с метали и неметали. В тесен смисъл терминът карбид се отнася до съединенията на въглерода с металите. От всички елементи само кислородът, сярата, азотът, флуорът, хлорът и бромът са по-електроотрицателни от въглерода и техните съединения са извън групата на карбидите. Карбидите могат да бъдат разделени на три групи: йонни, метални и ковалентни.
Въглеродни оксиди[редактиране | редактиране на кода]
Въглеродният монооксид, наричан също въглероден оксид или с остарялото си название въглероден окис, е газ без цвят и мирис, с моларна маса 28 g/mol (по-лек от въздуха). Химичната му формула е CO. Той е продукт от непълното изгаряне на съдържащи въглерод вещества при липса на достатъчно кислород, необходим за пълното окисление до въглероден диоксид (CO2).
Въглеродният диоксид (остаряло[9] въглероден двуокис) е химично съединение, чиято молекула се състои от един атом въглерод и два атома кислород. Химичната формула на въглеродния диоксид е CO2. Той е газ без цвят и със специфична остра и задушлива миризма. Получава се като продукт при дишането на живите организми, както и при горенето.
Цианиди и Цианови производни[редактиране | редактиране на кода]
Цианидите са соли на циановодородната (синилна) киселина HCN, например NaCN (натриев цианид), KCN (калиев цианид, цианкалий). CN-група съдържат и други химични съединения, например нитрили, уретани и др.
Повечето видове цианиди са силно отровни.[10] Ефектът им върху живи организми е блокиране на клетъчното дишане (който ефект обаче е обратим в кратки срокове). Цианидите са редуктори, ползват се в бижутерията, при горещо поцинковане на металите. В България все още се използват на някои места, въпреки че се води дискусия за премахването му.
Полуорганични киселини[редактиране | редактиране на кода]
Синилна киселина[редактиране | редактиране на кода]
Циановодород (циановодородна или синилна киселина) е неорганично химично съединение с химична формула HCN и представлява безцветна, силно летлива, лесноподвижна течност с характерен мирис.
Циановодородната киселина се съдържа в някои растения, коксов газ, цигарен дим, отделя се по време на термично разлагане на найлон, полиуретан. Смесва се във всякакви съотношения с вода, етанол, етилов етер. Молекулата му е силно полярна.
Циановодородът е силна отрова.
Въглеродна киселина[редактиране | редактиране на кода]
Въглеродната киселина е химично съединение с химична формула H2CO3. В природата въглеродна киселина се образува при разтварянето на въглероден диоксид във вода: H2O+CO2->H2CO3. При 20 °C един обем вода разтваря 0,88 обема СО2. Химичните връзки в молекулата на въглеродната киселина са ковалентни полярни.
Киселинни аниони от оксивъглерод[редактиране | редактиране на кода]
Алифатни или мастни съединения[редактиране | редактиране на кода]
Ароматни съединения[редактиране | редактиране на кода]
Въглеводороди[редактиране | редактиране на кода]
Въглеводородите са основен клас органични съединения. Почти всички други органични вещества могат да се разглеждат като производни на въглеводородите. По химичен състав те са най-простите органични съединения, тъй като молекулите им са изградени само от въглеродни и водородни атоми.
Алкани[редактиране | редактиране на кода]
| Наименование | Химична формула |
|---|---|
| Метан | CH4 |
| Етан | C2H6 |
| Пропан | C3H8 |
| Бутан | C4H10 |
| Пентан | C5H12 |
| Хексан | C6H14 |
| Хептан | C7H16 |
| Октан | C8H18 |
| Нонан | C9H20 |
| Декан | C10H22 |
| Обща формула | CnH2n + 2* |
Алкени[редактиране | редактиране на кода]
Алкените са хомоложен ред от ненаситени въглеводороди с обща формула CnH2n. Съдържат една двойна връзка между въглеродните атоми в молекулата си. Висшите членове на реда имат изомери.
Наименованията на видовете алкени завършват на -ен, например етен, пропен, бутен. Алкените още се наричат олефини (по-остарял синоним, широко използван в петролната промишленост).
| Брой въглеродни атоми |
Имена | Формула |
|---|---|---|
| 2 | Етен | C2H4 |
| 3 | Пропен | C3H6 |
| 4 | Бутен | C4H8 |
| 5 | Пентен | C5H10 |
| 6 | Хексен | C6H12 |
| 7 | Хептен | C7H14 |
| 8 | Октен | C8H16 |
| 9 | Нонен | C9H18 |
| 10 | Децен | C10H20 |
Алкини[редактиране | редактиране на кода]
Алкините в химията са хомоложен ред от ненаситени въглеводороди с обща формула CnH2n-2. Съдържат една тройна връзка между два от въглеродните атоми в молекулата си.
Наименованията на видовете алкини завършват на -ин, например въглерод: C , етин : H-C≡C-H
Алкините още се наричат ацетилени.
За разлика от алканите и в по-малка степен от алкените, алкините са много реактивни и нестабилни съединения. Отличават се с висока киселинност и имат pKa стойности (25) между тези на амоняка (35) и етанола (16). между алкани, алкени и алкини има генетична връзка. Имат висока температура на кипене и топене.малко разтворими във вода, но по-добре от останалите.
Химични свойства:Участват в присъединителни реакции като присъединяват водород, вода, халогени, халогеноводороди. Взаимодействат с водород като първо се разкъсва едната пи връзка, после и другата, и се получава алкан със същия брой въглеродни атоми. Горят като се получава СО2 и Н2О.
Алкадиени-въглеводороди с 2 двойни връзки.според разположението на двете двойни връзки има няколко вида алкадиени: >С=С=С< и други. физичните им свойства са подобни на алкените.пи връзките диктуват химичните свойства.
| Брой въглеродни атоми | Имена | Формула |
|---|---|---|
| 2 | Етин | C2H2 |
| 3 | Пропин | C3H4 |
| 4 | Бутин | C4H6 |
| 5 | Пентин | C5H8 |
| 6 | Хексин | C6H10 |
| 7 | Хептин | C7H12 |
| 8 | Октин | C8H14 |
| 9 | Нонин | C9H16 |
| 10 | Децин | C10H18 |
| Общо име | Алкини |
Функционални групи[редактиране | редактиране на кода]
Това са специални групи от атоми в молекулата, които са отговорни за нейните специфични химични реакции и свойства. Еднаквите функционални групи встъпват в еднакви или подобни химични реакции, независимо от големината на молекулата, част от която са. Съединения с една и съща функционална група, но различна дължина на въглеродната верига образуват т.нар. хомоложен ред: напр. алкани, алкохоли, алдехиди, кетони, карбоксилни киселини и т.н.
Пример за влиянието на функционалната група върху химичните и физичните свойства е даден в следната таблица:
| Функционална група/Хомоложен ред | Съединение | Химическа формула | Свойства |
|---|---|---|---|
| Изходно съединение / Алкан | Бутан | H3C–CH2–CH2–CH3 | газ, неразтворим във вода, неутрален и слабореактивен |
| Карбоксилна група /Карбоксилна киселина | Бутанова киселина | H3C–CH2–CH2–COOH | течност с лоша миризма, има свойствата на киселина, разтворима във вода |
| Аминогрупа / Амин | Бутиламин | H3C–CH(NH2)–CH2–CH3 | течност с лоша миризма, има свойствата на слаба основа, разтворим във вода |
| Аминогрупа и Карбоксилна група / Аминокиселина | Аминобутанова киселина | H2N–CH2–CH2–CH2–COOH | твърдо вещество, във вода е под формата на цвитерион H3N+–CH2–CH2–CH2–COO−,
амфотерни свойства, разтворима във вода |
Комбинирането на имената на функционалните групи с тези на изходните алкани дава рационална номенклатура за именуване на органичните съединения.
Атомите на функционалната група са свързани помежду си и към цялата молекула посредством ковалентна връзка. Когато групата от атоми е свързана с останалата част от молекулата чрез йонна връзка, говорим за полиатомен йон или комплексен йон. Всички те се наричат „радикал“.
Първият въглероден атом след този, с който е свързана функционалната група, се нарича алфа; вторият бета; третия гама и т.н. При наличието на повече от една функционална група броенето започва от тази, чиито атом заловен за основната верига е с по-голяма атомна маса.
Хомоложни редове[редактиране | редактиране на кода]
Наситени съединения[редактиране | редактиране на кода]
Ненаситени съединения[редактиране | редактиране на кода]
Неорганични[редактиране | редактиране на кода]
Соли и други неорганични съединения[редактиране | редактиране на кода]
Солите са йонни химични съединения и често се получават в резултат на неутрализационна реакция между киселина и основа. Разтворите на соли във вода се наричат електролити и играят важна роля в електрохимията. Солите, които при хидролиза образуват хидроксилни аниони се наричат основни соли, а тези, които образуват водородни катиони – киселинни соли. Останалите соли се наричат неутрални соли.
- Сулфиди се наричат всички вещества получени от взаимодействието на произволен, но възможен химичен елемент със сяра.
- Оксиди са химични съединения, в чийто състав участват два химични елемента, един от които е кислородът.
- Сулфити са вещества, получени от взаимодействие със серниста киселина
- Сулфати са веществата получени от взаимодействие със сярна киселина.
- Пероксомоносулфати са продукти получени от взаимодействие с пероксомоносярна киселина.
- Пероксодисулфати са продукти получени от взаимодействие с пероксодисярна киселина.
- Пиросулфати са веществата получени от взаимодействие със пиросярна киселина.
- Тиосулфати са продукти получени от взаимодействие с тиосярна киселина.
- Дитионати са продукти получени от взаимодействие с дитионова киселина.
- Сулфити са продукти получени от взаимодействие със серниста киселина.
- Дитионити са веществата получени от взаимодействие с дитиониста киселина.
- Тиосулфити са продукти получени от взаимодействие с тиосерниста киселина.
- Дисулфити са продукти получени от взаимодействие с дисериста киселина.
- Сулфоксилати са продукти получени от взаимодействие със сулфоксилова киселина.
- Политионати са продукти получени от взаимодействие с политионови киселини.
- Пероксидосулфати са продукти получени от взаимодействие с пероксодисярна киселина.
- Селениди се наричат всички вещества получени от взаимодействието на произволен, но възможен химичен елемент със селен.
- Селенати са веществата получени от взаимодействие със селенова киселина.
- Селенити са веществата получени от взаимодействие със селениста киселина.
- Телуриди се наричат всички вещества получени от взаимодействието на произволен, но възможен химичен елемент със телур.
- Телурати са веществата получени от взаимодействие със телурова киселина.
- Телурити са веществата получени от взаимодействие със телуриста киселина.
- Флуориди са продукти получени от реакцията с флуор.
- Хипофлуорити са продукти получени от реакцията с хипофлуориста киселина.
- Хлориди са продукти получени от реакцията с хлор.
- Хипохлорити са продукти получени от реакцията с хипохлориста киселина.
- Хлорити са продукти получени от реакцията с хлориста киселина.
- Хлорати са продукти получени от реакцията с хлорна киселина.
- Перхлорати са продукти получени от реакцията с перхлорна киселина.
- Бромиди са продукти получени от реакцията с бром.
- Хипобромити са продукти получени от реакцията с хипобромиста киселина.
- Бромити са продукти получени от реакцията с бромиста киселина.
- Бромати са продукти получени от реакцията с бромна киселина.
- Пербромати са продукти получени от реакцията с пербромна киселина.
- Йодиди са продукти получени от реакцията с йод.
- Хипойодити са продукти получени от реакцията с хипойодиста киселина.
- Йодити са продукти получени от реакцията с йодиста киселина.
- Йодати са продукти получени от реакцията с йодна киселина.
- Перйодати са продукти получени от реакцията с перйодна киселина.
- Карбиди са продукти получени от реакция с въглерод.
- Карбонати и хидрогенкарбонати са продукти получени от взаимодействие с въглеродна киселина.
- Нитриди са продукти получени от реакция с азот.
- Нитрати са продукти получени от реакция с азотна киселина.
- Пероксонитрати са продукти получени от реакция с пероксоазотна киселина.
- Нитрити са продукти получени от реакция с азотиста киселина.
- Пероксонитрити са продукти получени от реакция с пероксоазотиста киселина.
- Хипонитрити са продукти получени от реакция с хипоазотиста киселина.
- Фосфиди са продукти получени от реакция с фосфор.
- Фосфити са продукти получени от взаимодействие с фосфориста киселина.
- Фосфати са продукти получени от реакция с фосфорна киселина.
- Пирофосфати са продукти получени от реакция с пирофосфорна киселина.
- Трифосфати са продукти получени от реакция с трифосфорна киселина.
- Полифосфати са продукти получени от реакция с полифосфорна киселина.
- Циклотриметафосфати са продукти получени от реакция с циклотриметафосфорна киселина.
- Циклотетраметафосфати са продукти получени от реакция с циклотетраметафосфорна киселина.
- Полиметафосфати са продукти получени от реакция с полиметафосфорна киселина.
- Пероксомонофосфати са продукти получени от реакция с пероксомонофосфорна киселина.
- Пероксодифосфати са продукти получени от реакция с пероксодифосфорна киселина.
- Хипофосфати са продукти получени от реакция с хипофосфорна киселина.
- Изохипофосфати са продукти получени от реакция с изохипофосфорна киселина.
- Фосфити са продукти получени от реакция с фосфориста киселина.
- Пирофосфити са продукти получени от реакция с пирофосфориста киселина.
- Хипофосфити са продукти получени от реакция с хипофосфориста киселина.
Киселини[редактиране | редактиране на кода]

Киселините са химични съединения, които във воден разтвор отделят водородни катиони, H+ и оцветяват лакмусовата хартия в червен цвят. Водородният показател (pH) за тези съединения е по-малък от 7. Примери за киселини са оцетната киселина и сярната киселина. От гледна точка на електролитната дисоциация киселините са съединения, които във воден разтвор се дисоциират само на водородни катиони и киселинни аниони. Атомите на киселините са свързани чрез ковалентна полярна връзка. Общите химични свойства на водните им разтвори се дължат на водородните йони.
Примери за киселини са: хлороводород HCl, сярна киселина H2SO4, оцетна киселина CH3COOH и други.
Основи[редактиране | редактиране на кода]
Според теорията за електролитната дисоциация на Сванте Арениус основите са химични съединения, които във воден разтвор се дисоциират на метални катиони и хидроксидни аниони или взаимодействайки с киселини, дават вода и сол (химичната реакция се нарича неутрализация). Химичните свойства на основите се определят от общата хидроксилна група. Реагират с киселини, киселинни оксиди, амфотерни оксиди, амфотерни хидроксиди. Специфични реакции за някои основи са взаимодействията със соли и прости вещества на елементи с двойствен характер и халогенни елементи, както и участие в окислително-редукционни процеси. Една от най-известните е натриевата основа
Редки съединения[редактиране | редактиране на кода]
Редките съединения са трудно намерими в обществото и в природата, напр.: всички съединения на ниобия.
Вижте също[редактиране | редактиране на кода]
- Агрегатно състояние
- Алотропия
- Анион
- Атом
- Вещество
- Изотоп
- Йон
- Катион
- Кристал
- Минерал
- Молекула
- Просто вещество
- Скала
- Сложно вещество
- Смес
- Физични свойства
- Химичен елемент
- Химична връзка
- Химични реакции
- Химични свойства
- Химично вещество
- Химично заместване
- Химично разлагане
- Химично съединяване
Източници[редактиране | редактиране на кода]
- ↑ Brown, Theodore L., LeMay, H. Eugene, Bursten, Bruce E. Chemistry: The Central Science, AP Edition. 11th. Upper Saddle River, NJ, Prentice Hall, 2009. ISBN 0132364891. с. 5 – 6.
- ↑ Hill, John W., Petrucci, Ralph H., McCreary, Terry W. General Chemistry. 4th. Upper Saddle River, NJ, Prentice Hall, 2005. ISBN 9780131402836. с. 6.
- ↑ а б Whitten, Kenneth W., Davis, Raymond E., Peck, M. Larry. General Chemistry. 6th. Fort Worth, TX, Saunders College Publishing/Harcourt College Publishers, 2000. ISBN 9780030723735. с. 15.
- ↑ Wilbraham, Antony, Matta, Michael, Staley, Dennis. Chemistry. 1st. Upper Saddle River, NJ, Prentice Hall, 2002. ISBN 0132512106. с. 36.
- ↑ Halal, John. Chapter 8: General Chemistry // Milady's Hair Structure and Chemistry Simplified. 5. Milady Publishing, 2008. ISBN 1428335587. с. 96 – 98.
- ↑ Proust, J.-L. (1799). Researches on copper, Ann. chim., 32:26-54. Excerpt, in Henry M. Leicester and Herbert S. Klickstein, A Source Book in Chemistry, 1400—1900, Cambridge, MA: Harvard, 1952. Accessed 2008-05-08
- ↑ Helmenstine, Anne. Law of Multiple Proportions Problem // 1. Архивиран от оригинала на 2012-11-07. Посетен на 2012-01-31.
- ↑ law of multiple proportions definition
- ↑ В химичната терминология окис е заменено с оксид през 1980-те години; вж Оксид
- ↑ Environmental and Health Effects of Cyanide // International Cyanide Management Institute, 2006. Архивиран от оригинала на 2012-11-30. Посетен на 4 август 2009.
Външни препратки[редактиране | редактиране на кода]
 В Общомедия има медийни файлове относно Химично съединение
В Общомедия има медийни файлове относно Химично съединение- Списък на химични съединения Архив на оригинала от 2010-07-12 в Wayback Machine.
|