Фосфор
| Фосфор | |||||||||||||||||||||
 Три от алотропите на фосфора – бял (ляво); червен (център); виолетов (дясно) | |||||||||||||||||||||
| |||||||||||||||||||||
| Общи данни | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Име, символ, Z | Фосфор, P, 15 | ||||||||||||||||||||
| Група, период, блок | 15, 3, p | ||||||||||||||||||||
| Химическа серия | неметал | ||||||||||||||||||||
| Електронна конфигурация | [Ne] 3s2 3p3 | ||||||||||||||||||||
| e- на енергийно ниво | 2, 8, 5 | ||||||||||||||||||||
| CAS номер | 12185-10-3 (бял) 7723-14-0 (червен) | ||||||||||||||||||||
| Свойства на атома | |||||||||||||||||||||
| Атомна маса | 30,973 u | ||||||||||||||||||||
| Атомен радиус (изч.) | 100 (98) pm | ||||||||||||||||||||
| Ковалентен радиус | 107±3 pm | ||||||||||||||||||||
| Радиус на ван дер Ваалс | 180 pm | ||||||||||||||||||||
| Степен на окисление | 5, 4, 3, 2, 1[1], −1, −2, −3 | ||||||||||||||||||||
| Оксид | P2O5 и P2O3 (киселинни) | ||||||||||||||||||||
| Електроотрицателност (Скала на Полинг) | 2,19 | ||||||||||||||||||||
| Йонизационна енергия | I: 1011,8 kJ/mol II: 1907 kJ/mol III: 2914,1 kJ/mol IV: 4963,6 kJ/mol (още) | ||||||||||||||||||||
| Физични свойства | |||||||||||||||||||||
| Агрегатно състояние | твърдо вещество | ||||||||||||||||||||
| Алотропи | бял, червен, виолетов и черен фосфор | ||||||||||||||||||||
| Кристална структура (бял и червен) | кубична обемноцентрирана | ||||||||||||||||||||
| Кристална структура (виолетов и черен) | ромбоедрична | ||||||||||||||||||||
| Плътност | 1: 1823 kg/m³ 2: 2270 kg/m³ 3: 2360 kg/m³ 4: 2690 kg/m3 | ||||||||||||||||||||
| Температура на топене | 317,3 K (44,3 °C) (бял) | ||||||||||||||||||||
| Температура на кипене | 550 K (277 °C) (бял) | ||||||||||||||||||||
| Моларен обем | 1: 17,02×10-3 m3/mol | ||||||||||||||||||||
| Специф. топлина на топене | 1: 0,66 kJ/mol | ||||||||||||||||||||
| Специф. топлина на изпарение | 1: 51,9 kJ/mol | ||||||||||||||||||||
| |||||||||||||||||||||
| Топлопроводимост | 1: 0,236 W/(m·K) 2: 12,1 W/(m·K) | ||||||||||||||||||||
| Магнетизъм | диамагнитен[2] | ||||||||||||||||||||
| Модул на свиваемост | 1: 5 GPa 2: 11 GPa | ||||||||||||||||||||
| История | |||||||||||||||||||||
| Наименуван | от гръцкото Φωσφόρος – „Светлоносец“ | ||||||||||||||||||||
| Откритие | Хенинг Бранд (1669 г.) | ||||||||||||||||||||
| Най-дълготрайни изотопи | |||||||||||||||||||||
| |||||||||||||||||||||
| Фосфор в Общомедия | |||||||||||||||||||||
Фосфорът е химичен елемент, който се означава с латинската буква P в периодичната система на елементите, а атомният му номер е 15. Елементът фосфор съществува в две основни форми – бял фосфор и червен фосфор, но тъй като е силно реактивен, фосфорът никога не се намира в свободно състояние на Земята, поне в естествени условия. Многовалентен неметал от групата на азота, фосфорът се съдържа в неорганичните фосфатни скали и във всички живи клетки. Той е силно реактивен, блести слабо след реакция с кислород (оттук и името), среща се под различни форми, и е много важен елемент за живите организми. Под формата на фосфорна киселина той влиза в състава на нуклеиновите киселини, които играят важна роля при синтезните процеси в живата клетка. Солите на фосфорната киселина, главно калциевият фосфат, са основният градивен материал на костите на гръбначните животни. Големи количества фосфор се съдържат и в мозъчното вещество. Най-важната употреба на фосфора е в производството на торове. Също така той се използва широко при направата на експлозиви, кибрит, фойерверки, пестициди, пасти за зъби и перилни препарати.
В организмите на животните най-много фосфор се съдържа в костите, мускулите и нервните тъкани. В организма на човека се съдържа средно около 1,5 kg фосфор, като 1,4 kg – в костите, 0,130 kg в мускулите и 12 g – в нервите и мозъка.
История и откритие
[редактиране | редактиране на кода]При търсене на философския камък немският аптекар и алхимик Хениг Бранд (Hennig Brand) през 1669 г., при един от опитите си той нагрява остатъка от изпарена урина с въглища и пясък, и когато го оставя на тъмно, той видял, че съдържанието на колбата свети. Така той открил фосфора. Първо го нарича „студен огън“, а после му дава името фосфор (от гръцки phosphóros – „светоносен“). През 1715 г. Хенсинг установява, че фосфор се съдържа в мозъка, а през 1769 г. Ю. Хан доказва, че и в костите се съдържа голямо количество фосфор. Този факт по-късно се потвърждава и от шведския химик Карл Шееле. Той получава фосфор от пепелта, която се образува при изгарянето на кости.
Свойства
[редактиране | редактиране на кода]Физични
[редактиране | редактиране на кода]Химични
[редактиране | редактиране на кода]Активен неметал, реагира с кислород, халогени, сяра и много метали. Най-реактивоспособен е белият фосфор.
С вода и минерални киселини не взаимодейства.
При нагряване на бял фосфор с концентрирани разтвори на алкални основи се отделя фосфин[3]
- P4 + 3NaOH + 3H2O → PH3 + 3NaH2PO2
Хидриди
[редактиране | редактиране на кода]Фосфин (PH3) – безцветен, силно отровен газ с миризма на риба. Точка на топене – 133,8 °C, точка на кипене – 87,7 °C.
Директното взаимодействие с водород:
- 2P + 3H2 ⇄ 2PH3 + Q (ΔH = -9,2kJ/mol)
протича със забележима скорост едва при температура 300 °C, при която фосфинът се разлага. Поради това PH3 се получава индиректно, например:
- Ca3P2 + 6H2O → 3Ca(OH)2 + 2PH3
Оксиди
[редактиране | редактиране на кода]- Фосфорен (II) оксид, фосфорен оксид – (PO):
- 2POBr3 + 3Mg → 2PO + 3MgBr2
- Фосфорен (III) оксид, дифосфорен триоксид – (P4O6) или (P2O3):
- P4 + 3O2 → P4O6 (при недостиг на кислород)
- Фосфорен (IV) оксид – (P2O4):
- 4P4O6 → 6P2O4 + P4 (нагряване над 210 °C)
- Фосфорен (V) оксид, дифосфорен пентаоксид – (P4O10) или (P2O5):
- P4 + 5O2 → P4O10
- P4O6 + 2O2 → P4O10 (хемилуминисценция – слаба, бледа светлина)
- Фосфорен пероксид – (P2O6)
Хидроксиди
[редактиране | редактиране на кода]Хидроксидите на фосфора са дву- три- четири- и полиосновни средно силни киселини[3].
| Формула | Наименование | Структурна формула | Получаване |
|---|---|---|---|
| H3PO2 | Хипофосфориста киселина | 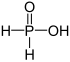 |
2P4 + 3Ba(OH)2 + 6H2O → 2PH3 + 3Ba(H2PO2)2; Ba(H2PO2)2 + H2SO4 → 2H3PO2 + BaSO4 |
| H4P2O6 | Хипофосфорна киселина |  |
H4P2O6 + H2O → H3PO3 + H3PO4 |
| H3PO3; H2(HPO3) |
Фосфориста киселина |  |
P4O6 + 6H2O → 4H3PO3 |
| H3PO4 | Фосфорна (Ортофосфорна) киселина |
 |
3P + 5HNO3 + 2H2O → 3H3PO4 + 5NO |
| H4P2O7; P2O5.2H2O |
Дифосфорна (Пирофосфорна) киселина |
2H3PO4 → H4P2O7 + H2O (нагряване до 215 °C) | |
| H3PO5 | Пероксимонофосфорна киселина |
 |
|
| H4P2O8 | Пероксидифосфорна киселина |
Соли
[редактиране | редактиране на кода]Алотропни форми
[редактиране | редактиране на кода]
При температура над 1000 °C фосфорът дава двуатомни молекули, P2, подобно на азота. При по-ниски температури са типични четириатомни P4 и полимерни P2∞ молекули.[3]
Белият фосфор е изграден от четириатомни молекули с молекулна кристална решетка. Бяло восъкоподобно вещество, което се разтваря в серовъглерод. Той е термодинамично нестабилен и силно отровен.[3]
Червеният фосфор се получава се от белия фосфор при престояване (или при нагряване в инертна среда). Аморфен червен прах, не се разтваря в серовъглерод, неотровен. При умерено нагряване на аморфен червен фосфор се получава кристална модификация, изградена от полимерни вериги от фосфорни атоми.[3]
Черният фосфор, най-стабилната форма на фосфора, се получава се от бял фосфор при нагряване до 200 °C и налягане 1,2 GPa.
Производство
[редактиране | редактиране на кода]Основен метод за получаване е редукция на фосфорни минерали с въглища в присъствие на силициев диоксид:
- 2Ca3(PO4)2 + 10C + 6SiO2 → 6CaSiO3 + P4 + 10CO
или
- 4Ca5(PO4)3F + 18SiO2 + 30C → 3P4 + 30CO + 18CaSiO3 + 2CaF2
Употреба
[редактиране | редактиране на кода]Биологична роля
[редактиране | редактиране на кода]Кръговрат на фосфора
[редактиране | редактиране на кода]Кръговратът на фосфора е по-различен от водния, въглеродния или азотния кръговрат, защото фосфорът се съдържа в утаечните скали, а не в атмосферата. Фосфорът е важна съставка на ДНК, на много молекули в живите клетки, и се съдържа в костите на гръбначните животни. Един по-малък и по-маловажен източник на фосфор е гуаното (животинският тор) на рибоядните морски птици.
Кръговратът на фосфора е един от най-бавните. Ерозията, причинена от дъжда и оттичащите се води на потоците, отстранява фосфора от фосфатната скала. Така почвата се захранва с фосфор, който е на разположение на растенията. Неорганичният фосфор се поглъща от корените на растенията и се използва за изграждането на органични съединения. Когато животните изяждат растенията, фосфорът се предава по веригата. Микроорганизмите разлагат мъртвите растителни и животински остатъци, минерализират ги и фосфорът се връща обратно във водата и почвата в изходно положение. Когато морските растения и животни изхвърлят отпадъци или загинат, органичният фосфор затъва в океана. Кръговратът на фосфора е отворена система. Фосфорът в почвата се разтваря във вода, която се влива във водните басейни. Част от този фосфор се използва от планктона, който от своя страна се изяжда от рибите. Тези риби след това се изяждат от морските птици, които отделят после гуано.
Източници
[редактиране | редактиране на кода]- ↑ Ellis, Bobby D. et al. Phosphorus(I) Iodide: A Versatile Metathesis Reagent for the Synthesis of Low Oxidation State Phosphorus Compounds // Inorganic Chemistry 45 (17). 2006. DOI:10.1021/ic060186o. p. 6864 – 74. (на английски)
- ↑ Magnetic susceptibility of the elements and inorganic compounds // CRC Handbook of Chemistry and Physics. 86th. Boca Raton (FL), CRC Press, 2005. ISBN 0-8493-0486-5. (на английски)
- ↑ а б в г д Д. Лазаров, Неорганична химия, УИ „Св. Климент Охридски“, София, 1993
Периодична система на елементите
| |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | ||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||||||||
| |||||||||||||||||||||||||||||||||||||||||



